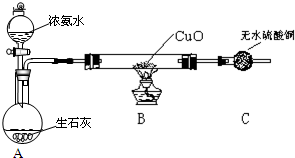
题目内容
7.在常压和500℃条件下,等物质量的氧化银,氢氧化铁,碳酸氢铵,碳酸氢钠完全分解,所得气体体积大小顺序是碳酸氢铵>氢氧化铁>碳酸氢钠>氧化银.分析 ①2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑,2mol氧化银产生1mol氧气;
②2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O↑,2mol氢氧化铁产生3mol水蒸气;
③NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O↑+CO2↑,2mol碳酸氢铵产生6mol气体;
④2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O↑,2mol碳酸氢钠产生2mol气体,根据方程式判断.
解答 解:各物质分解的方程式分别为:
①2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑,2mol氧化银产生1mol氧气;
②2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O↑,2mol氢氧化铁产生3mol水蒸气;
③NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O↑+CO2↑,2mol碳酸氢铵产生6mol气体;
④2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O↑,2mol碳酸氢钠产生2mol气体;
故各取2mol在500℃条件下加热完全分解,得到的气体体积由大到小的顺序为:碳酸氢铵>氢氧化铁>碳酸氢钠>氧化银,
故答案为:碳酸氢铵>氢氧化铁>碳酸氢钠>氧化银.
点评 本题考查化学方程式的有关计算,题目难度不大,注意有关反应的方程式的书写,氧化银的分解反应比较陌生,在金属的冶炼中涉及.

 阅读快车系列答案
阅读快车系列答案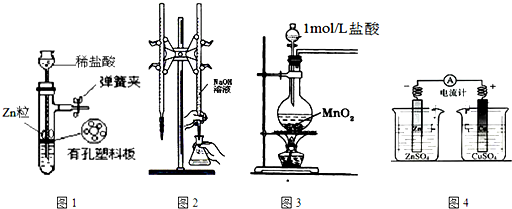
| A. | 用图1所示装置制取少量H2 | |
| B. | 用图2所示装置用标准浓度的氢氧化钠溶液测定盐酸的浓度 | |
| C. | 用图3所示装置制取少量Cl2 | |
| D. | 用图4所示装置确定导线中有电流通过及并确定电流方向 |
| A. | 酸碱中和滴定需将标准溶液直接注入到用水清洗后的滴定管中 | |
| B. | 若需94 mL1.00mol/LNaCl溶液,需称5.85g NaCl配制成100mL溶液 | |
| C. | 用一元酸和一元碱测定中和反应热时,取等体积等浓度的稀溶液为佳 | |
| D. | 测定稀酸或稀碱溶液的pH时,需将待测液直接滴在湿润的pH试纸上 |
2NH3(g)+CO2(g)?CO(NH2)2(I)+H2O(I)△H(I)
(1)已知合成尿素的反应分两步进行:
2NH3(g)+CO2(g)?NH2COONH4(s)△H1
NH2COONH4(s)?CO(NH2)2(I)+H2O(I)△H2
其能量变化曲线如图1所示,则△H、△H1和△H2由大到小的顺序为△H2>△H>△H1.
(2)在一个真空恒容密闭容器中充入CO2和NH3发生反应(I)合成尿素,恒定温度下混合气体中NH3的体积分数如图2所示.
A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);CO2的平衡转化率为75%.
(3)将一定量的氨基甲酸铵固体置于恒容真空容器中,发生反应:H2NCOONH4(s)?2NH3(g)+CO2(g).在不同温度(T1和T2)下,该反应达平衡状态时部分数据见下表.
| 温度 | 平衡浓度/(mol•L-1) | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 | |
| T2 | 0.1 | |
②下列能说明该分解反应达到平衡状态的是ac(填代号).
a.v生成(NH3)=2v消耗(CO2)
b.密闭容器内物质的总质量不变
c.密闭容器中混合气体的密度不变
d.密闭容器中氨气的体积分数不变
(4)氨基甲酸铵极易水解成碳酸铵,酸性条件下水解更彻底.25℃时,向1L 0.1mol•L-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.此时溶液中c(NH4+)=0.1mol/L;NH4+水解平衡常数值为4×10-9.

 二氧化碳是造成温室效应的主要气体,二氧化碳的回收在利用是减缓温室效应的有效途径之一.
二氧化碳是造成温室效应的主要气体,二氧化碳的回收在利用是减缓温室效应的有效途径之一.(1)二氧化碳重整可用于制取甲烷,已知:
CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247KJ•mol-1
CH4(g)+H2O(g)?CO(g)+3H2(g)△H2=+205KJ•mol-1
则反应CO2(g)+4H2(g)?CH2(g)+2H2O(g)的△H3=-165kJ•mol-1
(2)在一定压强下,在某恒定密闭容器中充入H2和CO2发生反应:
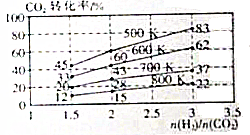
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.
| 温度/K CO2转化率/% a/mol | 500 | 600 | 700 | 800 |
| 1.67 | x | 33 | ||
| 1.25 | 60 | 43 | y | |
| 0.83 | z | 32 | w |
②在700K,起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5时,
H2的转化率为40%若达到平衡后,H2的浓度为a mol•L-1,则达到平衡时CH3CH2OH的浓度为0.1amol•L-1.
(3)CO2和H2在一定条件下可合成二甲醛:2CO2(g)+6H2(g)?CH3OH(g)+3H2O(g)△H.在一定压强下,将2.5mol H2与a mol CO2置于容积为1L的密闭容器中,发生上述反应,达到平衡状态时,测得反应的实验数据都如表:
①x,y的大小关系为B
A.x=y B.x>y C.x<y D.无法判断
②下列关于该反应的叙述正确的是ABC.
A.该反应的△H<0,△S<0
B.该反应的平衡常数随温度升高而减小
C.转化率分别为z,ω时,达到平衡的时间前者长
D.转化率分别为y,ω时,平衡常数不同.
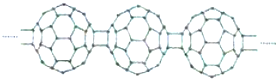
| A. | C60转变为X是物理变化 | B. | X中含积极性共价键 | ||
| C. | X与金刚石互为同位素 | D. | X能够发生加成反应 |