题目内容
17.在实验室进行下列有关的物质制备中,理论上正确、操作上可行、经济上合理的是( )| A. | C$\stackrel{在空气中点燃}{→}$CO$\stackrel{CuO,△}{→}$CO2$\stackrel{NaOH溶液}{→}$Na2CO3 | |
| B. | Cu$\stackrel{AgNO_{3}溶液}{→}$Cu(NO3)2溶液$\stackrel{NaOH溶液}{→}$Cu(OH)2 | |
| C. | Fe$\stackrel{点燃}{→}$Fe2O3$\stackrel{H_{2}SO_{4}溶液}{→}$Fe2(SO4)3溶液 | |
| D. | CaO$\stackrel{H_{2}O}{→}$Ca(OH)2溶液$\stackrel{Na_{2}CO_{3}}{→}$NaOH溶液 |
分析 理论上正确,要求物质的转化需符合物质的性质及变化规律;操作上可行,要求操作应简便易行;绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染.
A、一氧化碳是有毒的气体,碳在氧气中燃烧生成的进行实验时要进行尾气处理,且一氧化碳是可燃性气体,不纯时加热或点燃引起爆炸.
B、硝酸银价格较高.
C、铁在氧气中燃烧生成四氧化三铁
D、理论上正确,操作较为简便,利用碳酸钠获得氢氧化钠,经济上也合理,对环境几乎无影响,符合绿色化学.
解答 解:A、碳不完全燃烧可生成一氧化碳,一氧化碳高温下与氧化铜反应生成铜和二氧化碳,二氧化碳与氢氧化钠反应生成碳酸钠;理论上正确,反应过程中产生、利用污染环境的物质CO,不符合绿色化学,一氧化碳是有毒的气体,碳在氧气中燃烧生成的进行实验时要进行尾气处理,且一氧化碳是可燃性气体,不纯时加热或点燃引起爆炸,操作上较为复杂,故A错误;
B、铜与与硝酸银反应可生成硝酸铜,硝酸铜与氢氧化钠可生成氢氧化铜沉淀;理论上正确,操作上也较简便,但利用硝酸银、氢氧化钠制取氢氧化铜,经济上不合理,故B错误;
C、铁在氧气中燃烧生成四氧化三铁而不能生成三氧化二铁,因此该方案在理论上就是错误的,故C错误;
D、氧化钙与水反应可生成氢氧化钙,氢氧化钙与碳酸钠反应可生成氢氧化钠;理论上正确,操作也只需要加入液体较为简便,利用碳酸钠获得氢氧化钠,经济上也合理,符合绿色化学,故D正确;
故选D.
点评 本题考查实验准备方案设计与评价、绿色化学等,难度中等,是理论知识联系生活实际的体现、理论知识对实际的指导.注意实验方案设计应理论正确、操作简单可行、经济节约、绿色环保.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.工业上合成尿素的反应:
2NH3(g)+CO2(g)?CO(NH2)2(I)+H2O(I)△H(I)
(1)已知合成尿素的反应分两步进行:
2NH3(g)+CO2(g)?NH2COONH4(s)△H1
NH2COONH4(s)?CO(NH2)2(I)+H2O(I)△H2
其能量变化曲线如图1所示,则△H、△H1和△H2由大到小的顺序为△H2>△H>△H1.
(2)在一个真空恒容密闭容器中充入CO2和NH3发生反应(I)合成尿素,恒定温度下混合气体中NH3的体积分数如图2所示.
A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);CO2的平衡转化率为75%.
(3)将一定量的氨基甲酸铵固体置于恒容真空容器中,发生反应:H2NCOONH4(s)?2NH3(g)+CO2(g).在不同温度(T1和T2)下,该反应达平衡状态时部分数据见下表.
①T1< T2 (填“>”、“<”或“=”).
②下列能说明该分解反应达到平衡状态的是ac(填代号).
a.v生成(NH3)=2v消耗(CO2)
b.密闭容器内物质的总质量不变
c.密闭容器中混合气体的密度不变
d.密闭容器中氨气的体积分数不变
(4)氨基甲酸铵极易水解成碳酸铵,酸性条件下水解更彻底.25℃时,向1L 0.1mol•L-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.此时溶液中c(NH4+)=0.1mol/L;NH4+水解平衡常数值为4×10-9.

2NH3(g)+CO2(g)?CO(NH2)2(I)+H2O(I)△H(I)
(1)已知合成尿素的反应分两步进行:
2NH3(g)+CO2(g)?NH2COONH4(s)△H1
NH2COONH4(s)?CO(NH2)2(I)+H2O(I)△H2
其能量变化曲线如图1所示,则△H、△H1和△H2由大到小的顺序为△H2>△H>△H1.
(2)在一个真空恒容密闭容器中充入CO2和NH3发生反应(I)合成尿素,恒定温度下混合气体中NH3的体积分数如图2所示.
A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);CO2的平衡转化率为75%.
(3)将一定量的氨基甲酸铵固体置于恒容真空容器中,发生反应:H2NCOONH4(s)?2NH3(g)+CO2(g).在不同温度(T1和T2)下,该反应达平衡状态时部分数据见下表.
| 温度 | 平衡浓度/(mol•L-1) | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 | |
| T2 | 0.1 | |
②下列能说明该分解反应达到平衡状态的是ac(填代号).
a.v生成(NH3)=2v消耗(CO2)
b.密闭容器内物质的总质量不变
c.密闭容器中混合气体的密度不变
d.密闭容器中氨气的体积分数不变
(4)氨基甲酸铵极易水解成碳酸铵,酸性条件下水解更彻底.25℃时,向1L 0.1mol•L-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.此时溶液中c(NH4+)=0.1mol/L;NH4+水解平衡常数值为4×10-9.

3.体育竞技中服用兴奋剂既有失公平,也破坏了体育道德,以下是其中检测出的两种兴奋剂的结构:
关于它们的说法中正确的是( )

关于它们的说法中正确的是( )
| A. | Y遇到氯化铁溶液时显紫色,X能使溴的四氯化碳溶液褪色 | |
| B. | X含3个手性碳原子 | |
| C. | 1mol X与足量NaOH溶液反应,最多可消耗3mol NaOH | |
| D. | 1个Y分子中最多有8个原子共面 |
12.为实现下列实验目的,下表所提供的实验仪器和试剂都会用到且都正确的是( )
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 测定中和热 | 量筒、温度计、酒精灯 | 盐酸、NaOH溶液 |
| B | 制备氢氧化铁胶体 | 烧杯、胶头滴管、酒精灯 | 饱和FeCl3溶液 |
| C | 配制10%CuSO4溶液100g | 100ml 容量瓶、玻璃棒 | 胆矾 |
| D | 实验室制取、收集干燥的氨气 | 大试管、酒精灯 | 氯化铵、消石灰、无水CaCl2 |
| A. | A | B. | B | C. | C | D. | D |
2.20世纪80年代人们发现了碳的另一类单质,它们是由一系列偶数个碳原子组成的分子中C60(足球烯,分了中含有30个双键)是具代表性.X为n个C60连接而成的物质,结构如图( )
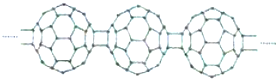

| A. | C60转变为X是物理变化 | B. | X中含积极性共价键 | ||
| C. | X与金刚石互为同位素 | D. | X能够发生加成反应 |
9.下列说法正确的是( )
| A. | 若某温度下,0.2 mol/L的醋酸与0.09 mol/L的氢氧化钡等体积混合后呈中性(不考虑混合后溶液体积的变化),则可算出该温度下醋酸的电离常数 K=9×10-7 mol/L | |
| B. | 若某温度下氯化银的Ksp=10-10mol2/L2,则100 mL0.2 mol/L的氯化钠溶液与0.18 mol/L硝酸银溶液等体积混合后(不考虑混合后溶液体积的变化),溶液中c(Ag+)为10-8 mol/L | |
| C. | 若某温度下1 L密闭容器中反应HCHO(g)十H2(g)?CH3OH(g)达到平衡后甲醛的转化率为50%,则该温度下该反应的平衡常数是2(mol/L)-1 | |
| D. | 若向氢氧化钙的饱和溶液中加人氢氧化钠溶液,则会有固体析出 |
7.在研究有机历程时,常用816O作为示踪原子.816O的原子核内中子数是( )
| A. | 8 | B. | 18 | C. | 10 | D. | 28 |

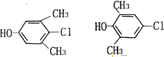 (写两种)
(写两种) 的化学方程式
的化学方程式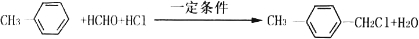 ,
,