题目内容
【题目】高锰酸钾是一种常用氧化剂,主要用于化工、防腐及制药工业等。可将软锰矿(主要成分为MnO2)和KClO3在碱性介质中制得K2MnO4,然后通入CO2制备高锰酸钾。已知:
温度 | 溶解度/g | ||||
K2CO3 | KHCO3 | KMnO4 | K2SO4 | CH3COOK | |
20℃ | 111 | 33.7 | 6.38 | 11.1 | 217 |
(1)制备锰酸钾的主要反应为:3MnO2+6KOH+KClO3=3K2MnO4+KCl+3H2O
①该反应中的氧化剂是_____________,还原剂是_____________。
②每生成 1mol K2MnO4转移_______ mol 电子。
(2)通入少量CO2气体时,锰酸钾发生歧化反应,生成KMnO4,MnO2,K2CO3。
①则生成的 KMnO4与MnO2的物质的量之比为__________。
②若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低,其原因是______________________________,可以把通CO2改为加其他的酸。从理论上分析,选用下列酸中_______,得到的产品纯度更高。
A.醋酸 B.浓盐酸 C.稀硫酸
【答案】KClO3 MnO2 2 2:1 KHCO3的溶解度比K2CO3小很多,滤液蒸发浓缩时KHCO3会随KMnO4一起结晶析出 A
【解析】
(1)![]() 该反应中,锰元素化合价升高,故
该反应中,锰元素化合价升高,故![]() 是还原剂,氯元素化合价降低;
是还原剂,氯元素化合价降低;
(2)①根据题目信息可以写出方程式为:![]() ;
;
②根据题目中的溶解度信息可以发现![]() 的溶解度比
的溶解度比![]() 小很多,故滤液蒸发浓缩时
小很多,故滤液蒸发浓缩时![]() 会随
会随![]() 一起结晶析出;盐酸具有还原性,能够还原高锰酸钾,加入醋酸生成醋酸钾,醋酸钾的溶解度比硫酸钾大的多,蒸发浓缩时会留在母液中,加入硫酸生成的硫酸钾溶解度小,会和高锰酸钾一起结晶析出而有杂质。
一起结晶析出;盐酸具有还原性,能够还原高锰酸钾,加入醋酸生成醋酸钾,醋酸钾的溶解度比硫酸钾大的多,蒸发浓缩时会留在母液中,加入硫酸生成的硫酸钾溶解度小,会和高锰酸钾一起结晶析出而有杂质。
(1)![]() 该反应中,锰元素化合价升高,故
该反应中,锰元素化合价升高,故![]() 是还原剂,氯元素化合价降低,故
是还原剂,氯元素化合价降低,故![]() 是氧化剂,该反应转移电子数是6,即生成3个锰酸钾转移6个电子,故每生成 1mol
是氧化剂,该反应转移电子数是6,即生成3个锰酸钾转移6个电子,故每生成 1mol![]() 转移2 mol 电子;
转移2 mol 电子;
答案为:![]() ;
;![]() ;2;
;2;
(2)①根据题目信息可以写出方程式为:![]() ,故生成的
,故生成的![]() 与
与![]() 的物质的量之比为2:1;
的物质的量之比为2:1;
②根据题目中的溶解度信息可以发现![]() 的溶解度比
的溶解度比![]() 小很多,故滤液蒸发浓缩时
小很多,故滤液蒸发浓缩时![]() 会随
会随![]() 一起结晶析出;盐酸具有还原性,能够还原高锰酸钾,加入醋酸生成醋酸钾,醋酸钾的溶解度比硫酸钾大的多,蒸发浓缩时会留在母液中,加入硫酸生成的硫酸钾溶解度小,会和高锰酸钾一起结晶析出而有杂质,故选择醋酸;
一起结晶析出;盐酸具有还原性,能够还原高锰酸钾,加入醋酸生成醋酸钾,醋酸钾的溶解度比硫酸钾大的多,蒸发浓缩时会留在母液中,加入硫酸生成的硫酸钾溶解度小,会和高锰酸钾一起结晶析出而有杂质,故选择醋酸;
答案为: 2:1 ;![]() 的溶解度比
的溶解度比![]() 小很多,滤液蒸发浓缩时
小很多,滤液蒸发浓缩时![]() 会随
会随![]() 一起结晶析出;A。
一起结晶析出;A。

【题目】氮的氧化物有许多重要的性质与用途,但过量排放则会导致严重的环境问题。
(1)汽车排放出的氮氧化物是导致雾霾形成的重要原因之一,汽车内安装的尾气处理器可大大降低氮氧化物的排放:2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH=x kJ/mol。
已知:N2(g)+O2(g)![]() 2NO(g) ΔH=+180.50kJ/mol
2NO(g) ΔH=+180.50kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ΔH=-566.00kJ/mol
2CO2(g) ΔH=-566.00kJ/mol
x =________________。
(2)向某恒容密闭容器中加入一定量的NO、CO并使它们之间发生反应,下图为在相同温度、压强、比表面积不同的催化剂(化学成分相同)的催化作用下,反应过程中NO的物质的量与时间之间的关系。
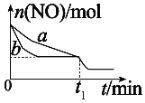
①表示催化剂比表面积较大的曲线是_________(填“a”或“b”)。
②t1min时改变(外界)的反应条件可能是____________。
(3)对于反应:mA(g)+nB(g) =pC(g)+qD(g)来说,若A、B通过一步反应能直接转化为C、D,则该反应的反应速率v=kcm(A)cn(B),其中k为只与温度有关的速率常数;若为可逆反应,则v(正)、v(逆)均存在类似的关系式,k正、k逆也只与温度有关。已知反应:2NO(g)+O2(g)![]() 2NO2(g)是通过下面两步完成的:
2NO2(g)是通过下面两步完成的:
①________________________________________(快)H1<0。
②N2O2(g)+O2(g)![]() 2NO2(g)(慢)H2<0。
2NO2(g)(慢)H2<0。
某科研小组测量出反应②的部分实验数据如下表所示:
c(N2O2)/mol/L | c(O2)/mol/L | v2正[mol/(L·s)] |
0.010 | 0.010 | 1.75 |
0.030 | 0.020 | 1.05 |
x | 0.030 | 1.05 |
i.用k2正表示②的正反应速率常数,则v2正=_________,x=_______,速率常数k2正=_______L·(mol·s)-1(填具体的数值)。
ii.在①的空白处写出化学方程式,若①②两个反应的正、逆反应速率常数分别用k1正、k1逆、k2正、k2逆表示,则2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K=____________(用速率常数表示);反应达到平衡后升高温度,在新平衡建立前,体系内c(N2O2)的大小变化情况是________。
2NO2(g)的平衡常数K=____________(用速率常数表示);反应达到平衡后升高温度,在新平衡建立前,体系内c(N2O2)的大小变化情况是________。
(4)在恒温恒容条件下,能表明2NO(g)+O2(g)![]() 2NO2(g)(只考虑总反应)己达到平衡状态的是_____________。
2NO2(g)(只考虑总反应)己达到平衡状态的是_____________。
a.混合气体密度保持不变 b.混合气体平均摩尔质量不变
c.正反应速率:v(NO)=v(NO2) d.生成NO2、O2的物质的量之比为1:2
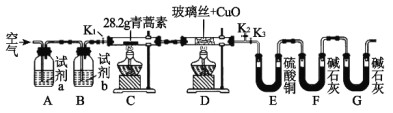
【题目】青蒿素是一种高效的抗疟药,某研究性学习小组的同学通过查阅资料获得如下信息:青蒿素是由碳、氢、氧三种元素所组成的,熔点为156~157℃,他们设计了如下装置来测量青蒿素的分子组成,回答下列问题:
装置 | 实验前/g | 实验后/g |
E | 22.6 | 42.4 |
F | 80.2 | 146.2 |
(1)试剂加入后首先要进行的操作是_____________,其目的是____________,实验中需要对开关K1、K2、K3进行操作,首次对开关K1、K2、K3进行操作的方法是________,适当时间后再关闭相应的开关,为提高实验的准确性,在C处停止加热后还应进行的操作是____________。
(2)试剂a、b分别是________________________________________,点燃C、D处酒精灯的先后顺序是___________________________,使用装置D的目的是___________。
(3)E中使用硫酸铜相对于使用CaCl2的好处(不考虑吸收效果的差异性)是_____。
(4)充分反应后获得的有关数据如上表(假设生成的气体全部被吸收):则测得青蒿素的最简式是_________________________。
(5)若要求出青蒿素的分子式,还需要通过实验测量出一个数据,请你指出该数据是什么,测量出该数据的方法是(只考虑理论上的可能性):___________。