题目内容
【题目】已知高能锂电池的总反应式为:2Li+FeS=Fe+Li2S[LiPF6SO(CH3)2为电解质],用该电池为电源进行如图的电解实验,电解一段时间测得甲池产生标准状况下H24.48L。下列有关叙述不正确的是
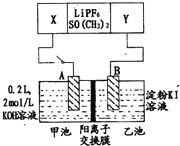
A.从隔膜中通过的离子数目为0.4NA
B.若电解过程体积变化忽略不计,则电解后甲池中溶液浓度为4mol/L
C.A电极为阳极
D.电源正极反应式为:FeS+2Li++2e-=Fe+Li2S
【答案】C
【解析】
A、由反应FeS+2Li=Fe+Li2S可知,Li被氧化,应为原电池的负极,FeS被还原生成Fe,为正极反应,正极方程式为FeS+2e-=Fe+S2-,A连接原电池负极,X为负极,A为阴极,生成氢气,电极方程式为2H++2e-=H2↑,n(H2)=4.48L÷22.4L/mol=0.2mol,转移0.4mol电子,生成0.4molOH-,则隔膜中通过的K+离子为0.4mol,通过的离子数目为0.4NA,A正确;
B、n(H2)=0.2mol,转移0.4mol电子,生成0.4molOH-,则隔膜H中通过的K+离子数为0.4mol,c(OH-)=(0.2L×2mol/L+0.4mol)÷0.2L=4mol/L,即电解后甲池中溶液浓度为4 mol/L,B正确;
C、A电极为阴极,C错误;
D、FeS被还原生成Fe,为正极反应,正极方程式为FeS+2e-=Fe+S2-,D正确;
答案选C。
【点晴】
该题侧重于学生的分析能力和计算能力的考查,明确离子交换膜的作用及阴阳极上发生的反应是解本题关键,计算量较大,计算时注意守恒法的灵活应用。

【题目】(1)比较下列粒子的半径大小
①Na Mg O F __________
②Na+ Mg2+ O2- F-__________
③Fe Fe2+ Fe3+__________
④Na+ Mg2+ S2- Cl-__________
(2)下列物质中:只存在共价键的是__________(填序号,下同),只存在离子键的是__________,既存在离子键又存在极性共价键的是__________,既存在离子键又存在非极性共价键的是__________。
①Ar ②CO2 ③Na2O2 ④KOH ⑤MgBr2 ⑥NH4Cl ⑦CaO ⑧H2SO4
(3)氢气可由天然气和水反应制备,其主要反应为:CH4(g)+ 2H2O(g) ===CO2(g)+4H2(g) 反应过程中能量变化如图所示,则该反应为__________反应(填“吸热”或“放热”)。若已知,破坏1mol化学键需要吸收的热量如代数式表示:
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | a | b | c | d |

则根据该反应制取1mol H2要吸收或放出热量为___________kJ(用含a、b、c、d字母表示)。
【题目】一定温度下,在密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如表所示,下列说法不正确的是
物质 | X | Y | Z | W |
初始浓度/mol·L-1 | 0.5 | 0.5 | 0 | 0 |
平衡浓度/mol·L-1 | 0.1 | 0.1 | 0.4 | 0.4 |
A. 反应达到平衡时,X的体积分数为10%
B. 该温度下反应的平衡常数K=16
C. 保持温度不变增大压强,反应速率加快,平衡向正反应方向移动
D. 若X、Y的初始浓度均为0.8 mol·L-1,则达到平衡时,W的浓度为0.64 mol·L-1
【题目】将E(g)和F(g)加入密闭容器中,在一定条件下发生反应:E(s)+4F(g)G(g),已知该反应的平衡常数如表所示。下列说法正确的是( )
温度/℃ | 25 | 80 | 230 |
平衡常数/(L3·mol-3) | 5×104 | 2 | 1.9×10-5 |
A.上述反应是熵增反应
B.25 ℃时,反应G(g)E(s)+4F(g)的平衡常数是0.5 mol3·L-3
C.在80 ℃时,测得某时刻,F、G的浓度均为0.5 mol·L-1,则此时v正>v逆
D.恒温恒容下,向容器中再充入少量G(g),达新平衡时,G的体积百分含量将增大