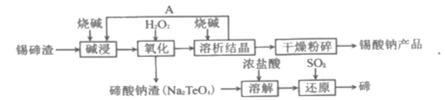
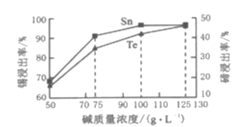
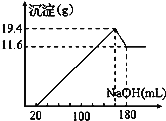
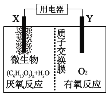
题目内容
【题目】现有Fe和Fe2O3组成的混合物27.2g,与100mL一定浓度稀硫酸恰好完全反应,放出标准状况下2.24L H2,向反应后的溶液中滴入KSCN溶液,未见红色。求混合物中Fe的质量____。
【答案】11.2g
【解析】
Fe和Fe2O3组成的混合物与硫酸反应,只有Fe能反应生成H2,Fe2O3与硫酸反应生成Fe3+和水,向反应后的溶液中滴入KSCN溶液,未见红色,说明单质铁将所有的Fe3+还原为了Fe2+,据此分析计算。
Fe和Fe2O3组成的混合物与硫酸反应,只有Fe能反应生成H2,因此生成H2消耗的铁的物质的量为![]() =0.1mol,Fe和Fe2O3组成的混合物与硫酸反应,向反应后的溶液中滴入KSCN溶液,未见红色,说明单质铁将所有的Fe3+还原为了Fe2+,反应方程式为:Fe+Fe2O3+3H2SO4=3FeSO4+3H2O,因此有n(Fe)= n(Fe2O3),那么根据Fe和Fe2O3组成的混合物27.2g可得56g/mol×n(Fe)+0.1mol×56g/mol+160g/mol×n(Fe2O3)=27.2,解得n(Fe)= n(Fe2O3)=0.1mol,混合物中Fe的质量m(Fe)=(0.1mol+0.1mol)×56g/mol=11.2g。
=0.1mol,Fe和Fe2O3组成的混合物与硫酸反应,向反应后的溶液中滴入KSCN溶液,未见红色,说明单质铁将所有的Fe3+还原为了Fe2+,反应方程式为:Fe+Fe2O3+3H2SO4=3FeSO4+3H2O,因此有n(Fe)= n(Fe2O3),那么根据Fe和Fe2O3组成的混合物27.2g可得56g/mol×n(Fe)+0.1mol×56g/mol+160g/mol×n(Fe2O3)=27.2,解得n(Fe)= n(Fe2O3)=0.1mol,混合物中Fe的质量m(Fe)=(0.1mol+0.1mol)×56g/mol=11.2g。

【题目】高锰酸钾是一种常用氧化剂,主要用于化工、防腐及制药工业等。可将软锰矿(主要成分为MnO2)和KClO3在碱性介质中制得K2MnO4,然后通入CO2制备高锰酸钾。已知:
温度 | 溶解度/g | ||||
K2CO3 | KHCO3 | KMnO4 | K2SO4 | CH3COOK | |
20℃ | 111 | 33.7 | 6.38 | 11.1 | 217 |
(1)制备锰酸钾的主要反应为:3MnO2+6KOH+KClO3=3K2MnO4+KCl+3H2O
①该反应中的氧化剂是_____________,还原剂是_____________。
②每生成 1mol K2MnO4转移_______ mol 电子。
(2)通入少量CO2气体时,锰酸钾发生歧化反应,生成KMnO4,MnO2,K2CO3。
①则生成的 KMnO4与MnO2的物质的量之比为__________。
②若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低,其原因是______________________________,可以把通CO2改为加其他的酸。从理论上分析,选用下列酸中_______,得到的产品纯度更高。
A.醋酸 B.浓盐酸 C.稀硫酸