题目内容
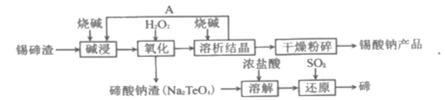
【题目】LiOH是制备锂离子电池的材料,可由电解法制备。工业上利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。下列说法正确的是
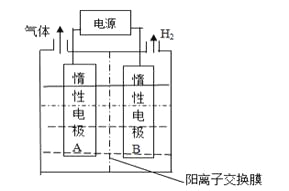
A.B极区电解液为LiOH溶液
B.电极每产生22.4L气体,电路中转移2mole-
C.电解过程中Li+迁移入B电极区、OH-迁移入A电极区
D.电解池中总反应方程式为:2HCl![]() 2H2↑+Cl2↑
2H2↑+Cl2↑
【答案】A
【解析】
试题A项、从图分析,右侧产生氢气,说明为阴极,溶液中的氢离子放电生成氢气,则在B极区产生大量的氢氧根离子,所以电解液为氢氧化锂,故A正确;
B项、没有说明气体是否在标况下,不能确定其转移电子数,故B错误;
C项、阳离子交换膜只能通过阳离子,氢氧根不能通过,故C错误;
D项、由题给图示可知,电解反应为电解氯化锂溶液生成氢气和氯气和氢氧化锂,故D错误;
故选A。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】高锰酸钾是一种常用氧化剂,主要用于化工、防腐及制药工业等。可将软锰矿(主要成分为MnO2)和KClO3在碱性介质中制得K2MnO4,然后通入CO2制备高锰酸钾。已知:
温度 | 溶解度/g | ||||
K2CO3 | KHCO3 | KMnO4 | K2SO4 | CH3COOK | |
20℃ | 111 | 33.7 | 6.38 | 11.1 | 217 |
(1)制备锰酸钾的主要反应为:3MnO2+6KOH+KClO3=3K2MnO4+KCl+3H2O
①该反应中的氧化剂是_____________,还原剂是_____________。
②每生成 1mol K2MnO4转移_______ mol 电子。
(2)通入少量CO2气体时,锰酸钾发生歧化反应,生成KMnO4,MnO2,K2CO3。
①则生成的 KMnO4与MnO2的物质的量之比为__________。
②若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低,其原因是______________________________,可以把通CO2改为加其他的酸。从理论上分析,选用下列酸中_______,得到的产品纯度更高。
A.醋酸 B.浓盐酸 C.稀硫酸