题目内容
3.现有如下两个反应:A、NaOH+HCl═NaCl+H2O B、2FeCl3+Fe═3FeCl2
(1)根据两反应本质,判断能否设计成原电池的是哪个反应:B;(填A或B)
(2)如果不能设计成原电池,说明其原因(A)的反应非氧化还原反应,没有电子转移;
(3)如果可以设计成原电池,则写出正、负极电极反应式,负极电极反应式Fe-2e-=Fe2+,正极电极反应式2Fe3++2e-=2Fe2+.
(3)利用(3)中反应:设计一个化学电池(给出若干导线,电极材料和电解液自选):
①标出电子流动方向;②注明负极电极材料;③写出电解质溶液.
(5)若该电池外电路中有6.02×1023个电子转移时,则电解质溶液质量增加了28g.
分析 (1)原电池反应必须是自发进行的放热的氧化还原反应,根据是否有电子转移判断是否能设计成原电池;
(2)原电池反应必须是自发进行的放热的氧化还原反应;
(3)原电池反应中,化合价升高的金属单质作负极,不如负极活泼的金属或导电的非金属作正极,得电子化合价降低的电解质溶液作该原电池电解质溶液;
(4)活泼的金属作负极,碳棒作正极,电解质溶液为氯化铁溶液,电子从负极流向正极,要形成闭合回路;
(5)由电极反应式可知Fe-2e-=Fe2+,若导线上转移电子2mol,则电解质溶液增重为56g.
解答 解:(1)原电池反应必须是自发进行的放热的氧化还原反应,(A)中各元素化合价不变,所以不是氧化还原反应,属于复分解反应,不能设计成原电池;(B)中反应前后Fe元素化合价由+3价变为+2价、Cu元素化合价由0价变为+2价,所以有电子转移,能设计成原电池,
故答案为:B;
(2)根据(1)知,(A)的反应非氧化还原反应,没有电子转移,所以(A)不能设计成原电池,故答案为:(A)的反应非氧化还原反应,没有电子转移;
(3)负极是活泼的金属,可以用活泼的铁作为负极材料,负极发生氧化反应,电极反应式为:Fe-2e-=Fe2+;正极是不活泼的碳棒,发生还原反应,电极反应式为:2Fe3++2e-=2Fe2+;故答案为:Fe-2e-=Fe2+,2Fe3++2e-=2Fe2+;
(4)活泼的金属作负极,碳棒作正极,电解质溶液为氯化铁溶液,电子从负极流向正极,要形成闭合回路,图为: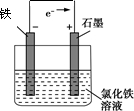 ,故答案为:
,故答案为: ;
;
(5)由电极反应式可知Fe-2e-=Fe2+,若导线上转移电子2mol,则电解质溶液增重为56g,所以外电路中有6.02×1023个电子转移时,即转移1mol的电子,所以电解质溶液增重28g,故答案为:28.
点评 本题考查了原电池的设计和工作原理的探究,为侧重于基础知识的考查,题目难度不大.

| A. | 锂 | B. | 铍 | C. | 氧 | D. | 钙 |
| A. | W、Y、Z三种元素的最高价氧化物的水化物可能有两种是强碱、一种是强酸 | |
| B. | Z元素在第3周期第ⅥA族 | |
| C. | W、Y、Z三种元素有两种是金属、一种是非金属 | |
| D. | W、X、Y三种元素最高价氧化物对应水化物的碱性依次增强 |
| A. | 将铜片置于盐酸中 | B. | 将锌片置于MgCl2溶液中 | ||
| C. | 将铁片置于CuSO4溶液中 | D. | Na2CO3 溶液与CaCl2溶液混合 |
| A. | 体积减半,则压强为原来的两倍 | |
| B. | 平衡向右移动,混合气体的颜色一定会变浅 | |
| C. | 体积减半,压强增大,但小于原来的2倍 | |
| D. | 体积减半,压强增大,且大于原来的2倍 |
| A. | 化学反应中一定有新物质生成 | |
| B. | 化学反应中旧的化学键的断裂需要吸收热量,新的化学键的生成需要放出能量 | |
| C. | 化学反应通常需要加热等条件才能发生 | |
| D. | 能量变化是化学反应的基本特征之一 |
| A. | Si和B | B. | N和Be | C. | S和Mg | D. | C和Al |
| A. | 硫酸铝与氨水反应:Al3++3 OH-═Al(OH)3↓ | |
| B. | 硅酸钠溶液中通入CO2气体:SiO32-+H2O+CO2═H2SiO3↓+CO32- | |
| C. | 饱和NH4Cl溶液中加入NaOH浓溶液:NH4++OH-═NH3↑+H2O | |
| D. | 氯气通入FeCl2溶液中:2Fe2++Cl2═2 Fe3++2Cl- |
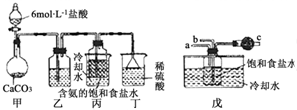 “侯氏制碱法”是我国化工专家侯德榜以NaCl、NH3、CO2等为原料制得NaHCO3,进而生产纯碱的一种化工方法.有关的化学反应方程式如下:
“侯氏制碱法”是我国化工专家侯德榜以NaCl、NH3、CO2等为原料制得NaHCO3,进而生产纯碱的一种化工方法.有关的化学反应方程式如下: