题目内容
【题目】下列说法正确的是( )
A.乙烯的结构简式是CH2CH2
B.乙酸和乙醇都既能与钠反应产生气体,又能与碳酸钠反应产生气体
C.C4H10的一氯取代物共有4种
D.标准状况下,22.4L氯仿中含有3molCl原子
【答案】C
【解析】
A. 乙烯含有碳碳双键,乙烯的结构简式是CH2=CH2,故A错误;
B. 乙酸含有羧基,乙酸能和碳酸钠反应产生二氧化碳气体,乙醇不能与碳酸钠反应,故B错误;
C. C4H10的一氯取代物有CH3CH2CH2CH2Cl、CH3CH2CHClCH3、(CH3)2CHCH2Cl、(CH3)3CCl,共有4种,故C正确;
D. 标准状况下氯仿是液体,22.4L氯仿的物质的量不是1mol,故D错误;
选C。

 名校课堂系列答案
名校课堂系列答案【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、S02等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知: ①NO2+CO![]() CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) △H=+179.5kJ/mol K2
2NO(g) △H=+179.5kJ/mol K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
写出NO与CO反应生成无污染气体的热化学方程式____________________________________,该热化学方程式的平衡常数K=_________(用K1、K2、K3表示)。
(2)在体积可变的恒压(p总)密闭容器中充入1molCO2 与足量的碳,让其发生反应: C(s)+ CO2(g)![]() 2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。
2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。
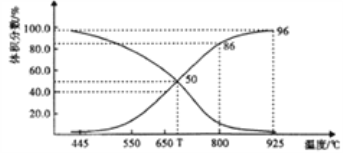
①T℃时,在容器中若充入稀有气体,v(正)___v(逆)(填“>”“<”或“="),平衡______移动(填“正向”“逆向”或“不”。下同);若充入等体积的CO2 和CO,平衡________移动。
②CO体积分数为40%时,CO2 的转化率为_______。
③已知:气体分压(p分)=气体总压×体积分数。用平衡分压代替平衡浓度表示平衡Kp常数的表达式为__________;925℃时,Kp=______(用含p总的代数式表示)。
(3)直接排放含SO2 的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。

①若是0.1mol/LNaOH 反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是______________。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2 溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因_______________________________________________。
【题目】NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
反应I:4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
反应 II:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H
2N2(g) +6H2O(g) △H
(1)
化学键 | H—O | O=O | N≡N | N—H |
键能kJ·molˉ1 | 463 | 496 | 942 | 391 |
△H=__________________ 。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是__________________。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:
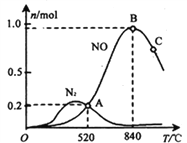
①该催化剂在高温时选择反应____________ (填“ I ”或“ II”)。
② 520℃时,4NH3(g)+5O2![]() 4NO(g) +6H2O(g)的平衡常数K=____________________________ (不要求得出计算结果,只需列出数字计算式)。
4NO(g) +6H2O(g)的平衡常数K=____________________________ (不要求得出计算结果,只需列出数字计算式)。
③有利于提高NH3转化为N2平衡转化率的措施有_______________
A.使用催化剂Pt/Ru
B.使用催化剂Cu/TiO2
C.增大NH3和O2的初始投料比
D.投料比不变,增加反应物的浓度
E.降低反应温度
(4)采用氨水吸收烟气中的SO2,
①若氨水与SO2恰好完全反应生成正盐,则此时溶液呈_____性(填“酸”或“碱”)常温下弱电解质的电离平衡常数如下:氨水:Kb=1.8×10ˉ5mol·Lˉ1;H2SO3 :Ka1=1.3×10ˉ2mol·Lˉ1,Ka2=6.3×10ˉ8mol·Lˉ1
②上述溶液中通入______气体可使溶液呈中性,(填“SO2”或NH3”)此时溶液离子浓度由大到小的顺序_________________________________。
【题目】(1)1780年,意大利解剖学家伽伐尼在用银质手术刀触碰放在铁盘上的青蛙时,无意间发现青蛙腿部肌肉抽搐了一下,仿佛受到电流的刺激。伽伐尼认为出现这种现象的原因是动物体内存在“生物电”。结合你所学的知识模拟该过程,下列哪种材质的手术刀触碰铁盘上的青蛙腿不会产生触动_________(填字母)。
a、铝 b、玻璃 c、银 d、铁
(2)1799年,伏打仔细研究了伽伐尼的发现,以含食盐水的湿抹布,夹在银和锌的圆形版中间,堆积成圆柱状,制造出世界上最早的电池-伏打电池。将洁净的金属片A、B、D、E分别放置在浸有盐溶液的滤纸上面并压紧(如下图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
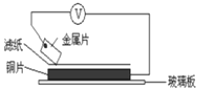
金属 | 电子流动方向 | 电压(V) |
A | A→Cu | +0.78 |
B | Cu→B | -0.15 |
D | D→Cu | +1.35 |
E | E→Cu | +0.30 |
已知:构成两电极的金属其金属活泼性相差越大,电压表的读数越大。请依据表中数据判断:_______金属可能是最强的还原剂;______金属一定不能从硫酸铜溶液中置换出铜。
(3)1836年,英国科学家丹尼尔对伏打电池进行改进,获得了世界上第一个具有稳定电流的电池,下图是丹尼尔电池的简易装置:
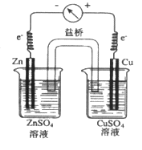
该电池的正极反应是_____________,负极反应 __________。
(4)随着社会的发展和科技的进步,越来越多的电池被制造出来。请选择适宜的材料和试剂设计一个原电池,使它的正极反应为:Fe3++e-=Fe2+以“![]() ”代表反应容器,“
”代表反应容器,“![]() ”代表导线,“
”代表导线,“![]() ”代表电极,“
”代表电极,“![]() ”代表小灯泡,
”代表小灯泡,
在下图方框内画出装置图并指出电极材料和电解质溶液,标出电源的正负极________。