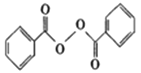
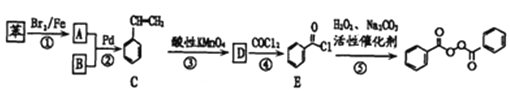
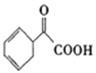
题目内容
【题目】下列离子方程式正确的是
A. 纯碱可用于去油污:CO32-+2H2O![]() 2OH-+H2CO3
2OH-+H2CO3
B. 醋酸去水垢:2H++CaCO3=Ca2++CO2↑+H2O
C. 工业制漂白粉:Cl2+2OH-=Cl-+ClO-+H2O
D. 实验室制备氢氧化铝:A13++3NH3·H2O=Al(OH)3↓+3NH4+
【答案】D
【解析】A.油脂是高级脂肪酸与甘油形成的酯,在碱性条件下,完全水解生成高级脂肪酸盐(肥皂)与甘油,碳酸根离子的水解,离子方程式CO32-+H2OHCO3-+OH-,HCO3-+H2OH2CO3+OH-,是分步进行的,故A错误;B.醋酸为弱酸,应写成化学式,故B错误;C.工业制漂白粉是用石灰乳和氯气反应,离子反应为:Cl2+Ca(OH)2=Ca2++Cl-+ClO-+H2O,故C错误;D.实验室制备氢氧化铝,是用可溶性铝盐与氨水反应,离子方程式为:Al3++3NH3H2O=Al(OH)3↓+3NH4+,故D正确;故选D。

【题目】向四只盛有相同量NaOH溶液的烧杯中通入不同量的CO2气体,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图:(忽略CO2的溶解和HCl的挥发),则下列分析都正确的组合是

对应图象 | 溶液中的主要成分 | |
A | Ⅰ | NaOH、NaHCO3 |
B | Ⅱ | NaHCO3、Na2CO3 |
C | Ⅲ | NaOH、Na2CO3 |
D | Ⅳ | Na2CO3 |
A. A. B. B C. C D. D
【题目】第四周期过渡元素常与H2O、NH3等形成配合物。
(1)写出Fe元素基态原子的价层电子排布式_______;
(2)C、N、O元素的第一电离能从大到小的顺序为___(用元素符号表示);
(3)向盛有硫酸铜水溶液的试管里加入过量氨水,得到蓝色溶液,铜离子形成了配位数为4的配离子,写出该配离子的结构式为______。
(4)由C、H、O、S中任两种元素构成甲、乙、丙三种分子,所含原子的数目依次为3、4、8,都含有18个电子。甲和乙的主要物理性质比较如下:
熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
甲 | 187 | 202 | 2.6 |
乙 | 272 | 423 | 以任意比互溶 |
①甲分子的电子式为_________,分子构型为___________;
②1 mol乙分子含有___个σ键;
③丙分子的中心原子采取_______杂化轨道;
④甲和乙的相对分子质量基本相同,造成上述物理性质差异的主要原因是 ____________(结合具体物质解释)。