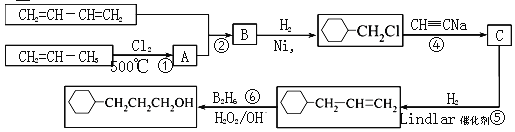
题目内容
【题目】为了测定某铜银合金的组成,将30.0g合金溶于80.0mL 13.5mol·L1的浓HNO3中。待合金完全溶解后,收集到气体6.72L(标准状况下)并测得H+浓度为1mol·L1。假设反应后溶液的体积为80.0mL,试计算:
(1)被还原的硝酸的物质的量___________;
(2)合金中银的质量分数___________。
(3)确定6.72L气体中各成分的物质的量___________。
【答案】0.3mol 36% n(NO)=0.2mol;n(NO2)=0.1
【解析】
(1)硝酸与金属反应不论是被还原为NO还是NO2,根据氮原子守恒可知被还原的硝酸的物质的量即为生成气体的物质的量,所以被还原的硝酸的物质的量为6.72 L÷22.4 molL-1=0.3 mol。
(2)剩余硝酸是1mol/L×0.08L=0.08mol,则参加反应的硝酸为13.5mol/L×0.08L-0.08mol=1.0mol。设合金中Cu和Ag的物质的量分别为x mol和y mol,则64.0x+108y=30.0,根据氮原子守恒可知2x+y=1.0-0.3=0.7,解得:x=0.3、y=0.1,所以银的质量分数为![]() ;
;
(3)设混合气体中NO、NO2的物质的量分别是a mol、b mol,则a+b=0.3,根据电子得失守恒可知3a+b=0.3×2+0.1,解得a=0.2、b=0.1,即6.72L气体中NO为0.2mol,NO2为0.1mol。

 高效智能课时作业系列答案
高效智能课时作业系列答案【题目】已知软锰矿和锰结核矿的主要成分均为MnO2,二氧化锰的制备和性质在生产生活和化学实验中有广泛应用。
二氧化锰的制备:
锰粉的主要成分为NH4Cl、C和MnO2,将锰粉进行如图所示操作后,可得到二氧化锰固体。

(1)某同学认为试剂a为蒸馏水,你认为______(填“能”或“不能”)实现实验目的。
(2)操作1的名称是______,所用到的玻璃仪器有烧杯、玻璃棒和______。
(3)在空气中充分灼烧的目的是_________。
二氧化锰的性质检验:
Ⅰ.氧化性
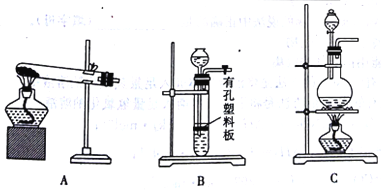
(4)实验室用MnO2与浓盐酸反应制备Cl2,可以选用的装置是______(填字母)。
(5)将MnO2放在NH3气流中加热,可得到棕黑色的Mn2O3和N2,该反应的化学方程式为_______。
Ⅱ.还原性
(6)下列流程所发生的反应中,氧化剂与还原剂的物质的量之比为______。
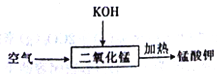
Ⅲ.催化性
MnO2是实验室制取O2的催化剂。某同学设计实验探究双氧水分解的实验方案如下表所示。
实验序号 | w(H2O2)/% | 粉状MnO2/g | 温度/℃ | 待测数据 |
① | 5 | 0 | 20 | |
② | 5 | 1.0 | 20 |
(7)本实验的待测数据是___________。
(8)由实验①和②可得出的结论是______________________。