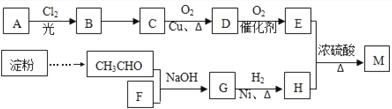
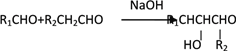题目内容
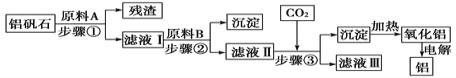
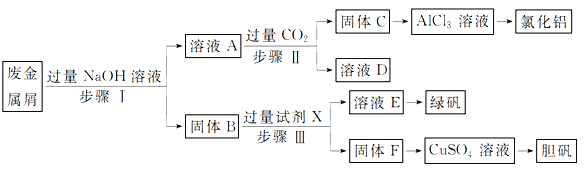
【题目】粉煤灰的综合利既有利于节约资源又有利于保护环境。某粉煤灰(主要含Al2O3、Fe2O3、CaCO3等)的铝、铁分离工艺流程如下:
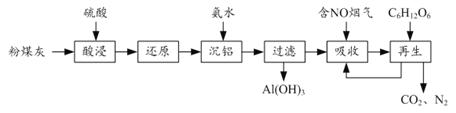
(1)①“酸浸”时Al2O3发生反应的离子方程式为______。
②当硫酸质量分数大于50%,金属氧化物浸出率明显下降。其原因是______。
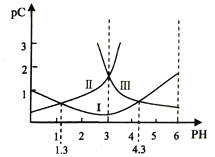
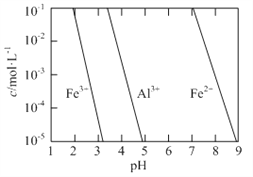
(2)有关金属离子以氢氧化物沉淀时离子浓度随pH变化如图所示。若浸出液不经还原直接与氨水混合,铝、铁元素分离效果较差的原因是______。
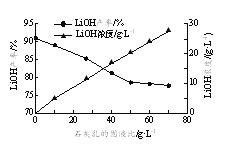
(3)沉铝后所得FeSO4溶液可用于烟气中NO吸收,其原理为Fe2++2NO![]() [Fe(NO)2]2+,烟气中O2的体积分数对NO吸收率的影响如图所示。
[Fe(NO)2]2+,烟气中O2的体积分数对NO吸收率的影响如图所示。
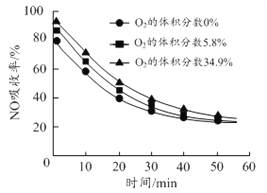
①为提高烟气中NO 的吸收率,可采取的措施有______(答一条,并说明理由)。
②“再生”过程中,[Fe(NO)2]2+在微生物的作用下与C6H12O6发生反应的离子方程式为______。
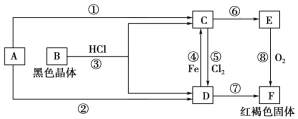
(4)Al(OH)3经过一系列反应可获得粗铝,利用熔融状态下物质密度不同,通过三层液电解精炼法可由粗铝获得高纯铝(装置如图所示)。
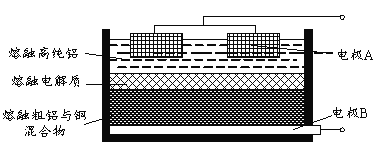
①该装置工作时,电极A作______极。
②熔融粗铝时加入铜的作用是______。
【答案】 Al2O3+6H+=2Al3++3H2O 生成的CaSO4覆盖在固体反应物表面,阻止铁、铝氧化物的溶解 Fe3+完全沉淀与Al3+开始沉淀的pH相近 增大FeSO4溶液浓度,有利于吸收NO的平衡向正反应方向移动或增大氧气含量,有利于NO与O2、H2O反应转化为HNO3等被吸收或减缓通入气体的速率,增大气液接触时间 C6H12O6+6[Fe(NO)2]2+![]() 6Fe2++ 6N2↑+ 6CO2↑+6H2O 阴 增大阳极熔融物的密度
6Fe2++ 6N2↑+ 6CO2↑+6H2O 阴 增大阳极熔融物的密度
【解析】(1)①“酸浸”时,粉煤灰(主要含Al2O3、Fe2O3、CaCO3等)中的Al2O3、Fe2O3、CaCO3被硫酸溶解,其中Al2O3发生反应的离子方程式为Al2O3+6H+=2Al3++3H2O,故答案为:Al2O3+6H+=2Al3++3H2O;
②硫酸钙微溶于水。当硫酸质量分数大于50%,生成的硫酸钙覆盖在固体反应物表面,阻止铁、铝氧化物的溶解,使得金属氧化物浸出率明显下降,故答案为:生成的CaSO4覆盖在固体反应物表面,阻止铁、铝氧化物的溶解;
(2)根据金属离子以氢氧化物沉淀时离子浓度随pH变化图像,Fe3+完全沉淀与Al3+开始沉淀的pH相近,导致浸出液不经还原直接与氨水混合,铝、铁元素分离效果较差,故答案为:Fe3+完全沉淀与Al3+开始沉淀的pH相近;
(3)①FeSO4溶液吸收NO的原理为Fe2++2NO![]() [Fe(NO)2]2+,为提高烟气中NO 的吸收率,可采取的措施有增大FeSO4溶液浓度,有利于吸收NO的平衡向正反应方向移动,根据烟气中O2的体积分数对NO吸收率的影响图像,可以增大氧气含量,有利于NO与O2、H2O反应转化为HNO3等被吸收,也可以减缓通入气体的速率,增大气液接触时间,故答案为:增大FeSO4溶液浓度,有利于吸收NO的平衡向正反应方向移动或增大氧气含量,有利于NO与O2、H2O反应转化为HNO3等被吸收或减缓通入气体的速率,增大气液接触时间;
[Fe(NO)2]2+,为提高烟气中NO 的吸收率,可采取的措施有增大FeSO4溶液浓度,有利于吸收NO的平衡向正反应方向移动,根据烟气中O2的体积分数对NO吸收率的影响图像,可以增大氧气含量,有利于NO与O2、H2O反应转化为HNO3等被吸收,也可以减缓通入气体的速率,增大气液接触时间,故答案为:增大FeSO4溶液浓度,有利于吸收NO的平衡向正反应方向移动或增大氧气含量,有利于NO与O2、H2O反应转化为HNO3等被吸收或减缓通入气体的速率,增大气液接触时间;
②“再生”过程中,[Fe(NO)2]2+在微生物的作用下与C6H12O6发生反应生成二氧化碳和氮气,反应的离子方程式为C6H12O6+6[Fe(NO)2]2+![]() 6Fe2++ 6N2↑+ 6CO2↑+6H2O,故答案为:C6H12O6+6[Fe(NO)2]2+
6Fe2++ 6N2↑+ 6CO2↑+6H2O,故答案为:C6H12O6+6[Fe(NO)2]2+![]() 6Fe2++ 6N2↑+ 6CO2↑+6H2O;
6Fe2++ 6N2↑+ 6CO2↑+6H2O;
(4)①根据电解目的,要将粗铝通过电解得到高纯铝,需要将粗铝作阳极,高纯铝作阴极,该装置工作时,电极A作阴极,故答案为:阴;
②熔融粗铝时加入铜可以增大阳极熔融物的密度,使之在最下层,故答案为:增大阳极熔融物的密度。

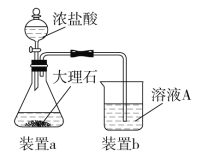
【题目】下图所示的实验,不能达到实验目的的是
A | B | C | D |
|
|
|
|
结合秒表测量锌与硫酸的反应速率 | 验证温度对化学平衡移动的影响 | 探究精炼铜的原理 | 证明酸性 CH3COOH>H2CO3>H3BO3 |
A. A B. B C. C D. D