题目内容
【题目】室温下,用0.10mol·L-1盐酸分别滴定20.00mL 0.10 mol·L-1氢氧化钾溶液和氨水,滴定过程中溶液pH随加入盐酸体积V(HCl)的变化关系如图。下列说法不正确的是( )
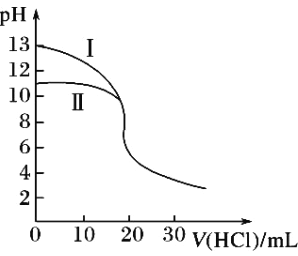
A. Ⅱ表示的是滴定氨水的曲线
B. 当pH=7时,滴定氨水消耗的V(HCl)<20mL,且此时溶液中c(NH4+)=c(Cl-)
C. 滴定氢氧化钾溶液时,若V(HCl)>20mL,则可能c(Cl-)>c(H+)>c(K+) >c(OH-)
D. 当滴定氨水消耗V(HCl)=10mL时,c(NH3H2O)>c(NH4+)>c(Cl-)>c(OH-)>c(H+)
【答案】D
【解析】
A.根据氨水和氢氧化钾在滴定开始时的pH来判断;
B.盐酸与氨水恰好反应生成氯化铵,溶液显酸性;
C.滴定氢氧化钾溶液时,若V(HCl)>20mL,氢离子浓度可能大于钾离子浓度;
D.根据图像,V(HCl)=10mL时,溶液显碱性,即NH3H2O的电离程度大于NH4+的水解程度。
A.氢氧化钾为强碱,一水合氨是弱碱,在溶液中部分电离,相同浓度时,一水合氨的pH小于氢氧化钾,所以Ⅱ表示的是滴定氨水的曲线,故A正确;
B.滴定氨水消耗的V(HCl)=20mL,盐酸与氨水恰好反应生成氯化铵,溶液显酸性,c(Cl-)>c(NH4+),当pH=7时,滴定氨水消耗的V(HCl)<20mL,根据电荷守恒,c(Cl-)=c(NH4+),故B正确;
C.滴定氢氧化钾溶液时,若V(HCl)>20mL,H+浓度肯定大于OH-浓度,可能大于K+浓度,则溶液中离子浓度关系可能为:c(Cl-)>c(H+)>c(K+)>c(OH-),故C正确;
D.当滴定氨水消耗V(HCl)=10mL时,溶液中溶质为等物质的量的NH3H2O和NH4Cl,根据图像,V(HCl)=10mL时,溶液显碱性,即NH3H2O的电离程度大于NH4+的水解程度,因此离子浓度大小顺序为c(NH4+)>c(Cl-)>c(NH3H2O)>c(OH-)>c(H+),故D错误。
故选D。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】草酸与高锰酸钾在酸性条件下能够发生如下反应:
MnO![]() +H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)
+H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)
用4 mL 0.001 mol·L-1KMnO4溶液与2 mL 0.01 mol·L-1 H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如表所示:
组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
Ⅰ | 2 | 20 | |
Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
Ⅲ | 2 | 30 | |
Ⅳ | 1 | 20 | 1 mL蒸馏水 |
(1)该反应中氧化剂和还原剂的物质的量之比为______________________。
(2)如果研究催化剂对化学反应速率的影响,使用实验____________和________(用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,使用实验________和________。
(3)对比实验Ⅰ和Ⅳ,可以研究____________对化学反应速率的影响,实验Ⅳ中加入1 mL蒸馏水的目的是______________________________________________________________。



