题目内容
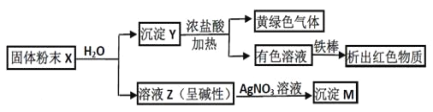
【题目】某包黑色固体混合物可能含有铁粉、氧化铜、炭粉中的二种或三种,取 86.4g 此固体混合物通足量氢气并加热使之反应完全,剩余固体质量 73.6g ,将此剩余固体溶于 1000mL0.500mol·L-1 硫酸中,过滤,向滤液中加入 500mL 某浓度 NaOH 溶液,恰好使沉淀完全,将沉淀灼烧得固体 32.0g。试计算:
(1)所用 NaOH 溶液的浓度是____________mol·L-1。
(2)固体混合物的成分及其物质的量之比是____________。
【答案】2.00 n(Fe):n(CuO)=1∶2
【解析】
将固体混合物通足量氢气并加热使之反应完全,固体质量由86.4g变为73.6g,减少的质量为O元素的质量,据此可计算出CuO的质量和物质的量,将用H2还原后的固体混合物用稀硫酸处理,Fe会发生反应形成FeSO4进入溶液,置换出来的Cu单质及可能混有的C单质仍以固体形式存在,过滤,向滤液中加入500mL某浓度NaOH溶液,NaOH先与过量的硫酸发生复分解反应,然后是NaOH与FeSO4发生复分解反应产生的沉淀为Fe(OH)2,将沉淀灼烧得固体是Fe2O3,质量是32.0g。根据Fe元素守恒可得Fe的质量,结合Fe、CuO的质量和与86.4g进行比较,可判断是否含有C元素及其质量大小。
(1)将灼烧后剩余固体用硫酸溶解,Fe变为FeSO4,加入NaOH溶液时,发生反应:H2SO4+2NaOH=Na2SO4+2H2O,FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,将固体过滤、洗涤,灼烧,Fe(OH)2变为Fe2O3,质量是32.0g,n(Fe2O3)=![]() ,n(Fe)=2n(Fe2O3)=0.4mol,根据Na、S元素守恒可得n(NaOH)=2n(H2SO4)=2×0.500mol/L×1L=1.000mol,由于NaOH溶液的体积为500mL,所以c(NaOH)=
,n(Fe)=2n(Fe2O3)=0.4mol,根据Na、S元素守恒可得n(NaOH)=2n(H2SO4)=2×0.500mol/L×1L=1.000mol,由于NaOH溶液的体积为500mL,所以c(NaOH)=![]() ;
;
(2)根据(1)分析可知n(Fe)=2n(Fe2O3)=0.4mol,m(Fe)=0.4mol×56g/mol=22.4g,由于原混合物质量是86.4g,用足量氢气还原后得到固体质量为73.6g,减少质量为其中含有的O元素的质量,n(O)=n(CuO)=![]() =0.8mol,根据Cu元素守恒可知n(CuO)=n(Cu)=0.8mol,则m(CuO)=0.8mol×80g/mol=64g,64g+22.4g=86.4g,CuO与Fe粉的质量和恰好为原固体的质量,说明原固体中只含有CuO、Fe单质,n(Fe):n(CuO)=0.4mol:0.8mol=1:2。
=0.8mol,根据Cu元素守恒可知n(CuO)=n(Cu)=0.8mol,则m(CuO)=0.8mol×80g/mol=64g,64g+22.4g=86.4g,CuO与Fe粉的质量和恰好为原固体的质量,说明原固体中只含有CuO、Fe单质,n(Fe):n(CuO)=0.4mol:0.8mol=1:2。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)![]() MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |