题目内容
【题目】工业合成氨反应:N2+3H22NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成![]() 键、
键、![]() 键、1molN≡N放出能量分别为436kJ、391kJ、946kJ。则:
键、1molN≡N放出能量分别为436kJ、391kJ、946kJ。则:
(1)若完全反应生成2mol![]() 可______
可______![]() 填“吸收”或“放出”
填“吸收”或“放出”![]() 热量______kJ。
热量______kJ。
(2)如果将![]() 和
和![]() 混合,使其充分反应,放出的热最总小于上述数值,其原因是______。
混合,使其充分反应,放出的热最总小于上述数值,其原因是______。
(3)实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过10min后,生成![]() ,则用
,则用![]() 表示的化学反应速率为______。
表示的化学反应速率为______。
(4)在四个不同容器中,不同条件下进行合成氨反应。根据在相同时内内测定的结果,判断该反应的速率由大到小的顺序是______![]() 用编号填写
用编号填写![]() 。
。
A.v(NH3)=0.5mol/(Lmin) B. v(H2)=0.3mol/(Lmin)
C.v(N2)=0.2mol/(Lmin) D. v(H2)=0.01mol/(Lmin)
【答案】放出 92 kJ 该反应为可逆反应,反应物不能完全转化为生成物,生成的氨气少于2mol,故放出的热值小于92 kJ 0.25mol/(Lmin) A>C>B>D
【解析】
根据反应热的公式可以计算反应热,反应热(对于可逆反应)是根据产物定义的,例如N2+3H22NH3,我们不能说是![]() 和
和![]() 完全反应放出的热量就是反应热,而应该说生成2mol
完全反应放出的热量就是反应热,而应该说生成2mol![]() 放出的热量为反应热;根据速率的公式可以进行计算速率,速率大小比较先统一单位,后转化为同一物质的速率比较大小。
放出的热量为反应热;根据速率的公式可以进行计算速率,速率大小比较先统一单位,后转化为同一物质的速率比较大小。
(1)N2+3H22NH3是一个放热的可逆反应,反应热=反应物总键能-生成物总键能=946+436×3-391×6=-92 kJ/ mol,若完全反应生成2mol![]() 可放出热量92 kJ;
可放出热量92 kJ;
(2)如果将![]() 和
和![]() 混合,使其充分反应,放出的热最小于上述数值,其原因是该反应为可逆反应,反应物不能完全转化为生成物,生成的氨气少于2mol,故放出的热值小于92 kJ;
混合,使其充分反应,放出的热最小于上述数值,其原因是该反应为可逆反应,反应物不能完全转化为生成物,生成的氨气少于2mol,故放出的热值小于92 kJ;
(3)v(NH3)=![]() =
=![]() =0.5mol/(Lmin),各物质的速率之比等于计量系数之比,则v(N2)=0.25mol/(Lmin);
=0.5mol/(Lmin),各物质的速率之比等于计量系数之比,则v(N2)=0.25mol/(Lmin);
(4)把不同物质的速率转化成同一物质的速率,注意同一单位,然后进行比较,A.v(NH3)=0.5mol/(Lmin),v(N2)=0.25mol/(Lmin) ,B. v(H2)=0.3mol/(Lmin) ,v(N2)=0.10mol/(Lmin), C.v(N2)=0.2mol/(Lmin) ,D. v(H2)=0.01mol/(Lmin) , v(N2)=0.0033mol/(Lmin),则该反应的速率由大到小的顺序是A>C>B>D;

 阅读快车系列答案
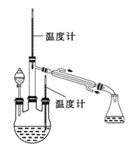
阅读快车系列答案【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |