题目内容
【题目】![]() 是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电泡等。可由电镀废渣(除镍元素外,还含有Cu、Zn、Fe、Cr等元素杂质)为原料获得。工艺流程如下:
是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电泡等。可由电镀废渣(除镍元素外,还含有Cu、Zn、Fe、Cr等元素杂质)为原料获得。工艺流程如下:

已知:①![]() 是一种不溶于水易溶于强酸的沉淀
是一种不溶于水易溶于强酸的沉淀
②已知![]() ,
,![]() 的
的![]()
(1)Ni的原子序数为28,则它在周期表中的位置为______,写出H2O2的结构式______。
(2)步骤①,用稀硫酸溶解废渣时,为了提高浸取率可采取的措施有______(任写一点)。
(3)步骤②,向滤液I中加入适量![]() 溶液的目的是除去Cu2+和
溶液的目的是除去Cu2+和![]() ,其中除去Cu2+的离子方程式为______;加
,其中除去Cu2+的离子方程式为______;加![]() 之前需控制pH不能太低的目的是______。
之前需控制pH不能太低的目的是______。
(4)步骤③的目的是除去Fe和Cr,温度不能太高的原因是__。若在![]() 时,调
时,调![]() 除去铁,此时溶液中
除去铁,此时溶液中![]() __。
__。
(5)滤液Ⅲ中溶质的主要成分是______,检验滤液Ⅲ中是否还有铁元素的试剂是______。
(6)粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度镍,下列叙述正确的是__(已知:氧化性Fe2+<Ni2+<Cu2+)
A.粗镍作阳极,纯镍作阴极
B.阳极发生还原反应,其电极反应式:![]()
C.电解过程中,阳极质量的减少与阴极质量的增加相等
D.电解后,溶液中存在的金属阳离子只有Cu2+和![]()
E.电解后,电解槽底部的阳极泥中只有Cu和Pt
【答案】第四周期,第Ⅷ族 H-O-O-H 加热、搅拌、适当增大硫酸浓度等 Cu2++ S2-=CuS↓ 避免生成H2S,影响除杂 防止H2O2受热分解 2.64![]() 10-9mol/L NiSO4、Na2SO4、Cr2(SO4)3 KSCN溶液 AE
10-9mol/L NiSO4、Na2SO4、Cr2(SO4)3 KSCN溶液 AE
【解析】
由图可知,向废渣中加入硫酸酸浸,废渣中的镍单质等与硫酸反应得到硫酸盐溶液,调pH过滤得滤液I,加Na2S的目的是除去铜、锌等杂质,加H2O2、NaOH的目的是除去铁等杂质,加Na2CO3的目的是除去铬等杂质,因此推断滤液I的主要成分是NiSO4、CuSO4、ZnSO4、FeSO4、Cr2(SO4)3,滤液II的主要成分是NiSO4、FeSO4、Cr2(SO4)3、Na2SO4,滤液III的主要成分是NiSO4、Cr2(SO4)3、Na2SO4,据此解答。
(1) Ni的原子序数为28,电子排布式为1s22s22p63s23p63d84s2,则应位于第四周期,第Ⅷ族;H2O2分子中含有两个H-O键和一个O-O键。结构式为H-O-O-H,
故答案为:第四周期,第Ⅷ族;H-O-O-H;
(2) 根据化学反应速率的影响因素及规律可知,可以通过固体废渣的粉碎、搅拌、加热、适当增加硫酸浓度等手段达到目的,
故答案为:加热、搅拌、适当增大硫酸浓度等;
(3) Na2S是可溶性盐,溶于水时电离出S2-,S2-与Cu2+易反应生成CuS沉淀,离子方程式为Cu2++ S2-=CuS↓;加Na2S之前需控制pH不能太低,否则会生成H2S,不利于除杂,
故答案为:Cu2++ S2-=CuS↓;避免生成H2S,影响除杂;
(4) 步骤③中加入过氧化氢,反应温度不能过高,主要是避免H2O2受热分解而损失;
![]() ,
,![]() 的
的![]() ,pH=4时c(OH-)=10-10mol/L,则有c(Fe3+)
,pH=4时c(OH-)=10-10mol/L,则有c(Fe3+)![]() (10-10)3=2.64
(10-10)3=2.64![]() 10-39,c(Fe3+)=2.64
10-39,c(Fe3+)=2.64![]() 10-9mol/L,
10-9mol/L,
故答案为:防止H2O2受热分解;2.64![]() 10-9mol/L;
10-9mol/L;
(5)根据以上分析,滤液Ⅲ中溶质的主要成分是Na2SO4、NiSO4;检验滤液Ⅲ中是否还有铁元素的试剂是KSCN溶液,
故答案为:Na2SO4、NiSO4;KSCN溶液;
(6) A.电解精炼镍时,用粗镍作阳极,纯镍作阴极,故A正确;
B. 阳极发生氧化反应,其电极反应式:Ni-2e-=Ni2+,Fe-2e-=Fe2+;Zn-2e-=Zn2+,故B错误;
C. 电解过程中阳极失电子的有Fe、Zn、Ni;阴极析出的是镍;根据电子守恒,阳极质量的减少与阴极质量的增加不相等,故C错误;
D.电解时要用NiSO4作电解液,所以电解后,溶液中存在的金属阳离子除Cu2+和![]() 还有
还有
E. 粗镍中含有少量Fe、Zn、Cu、Pt等杂质做阳极,铜和铂不失电子沉降电解池底部形成阳极泥,电解后,电解槽底部的阳极泥中只有Cu和Pt,故E正确。
故答案选AE。

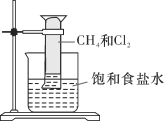
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
【题目】I.中和热测定:
(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、________、________。
(2)量取反应物时,取50 mL 0.50 mol·Lˉ1的盐酸,还需加入的试剂是________(填序号)。
a.50 mL 0.50 mol·Lˉ1NaOH溶液
b.50 mL 0.55 mol·Lˉ1NaOH溶液
c.1.0 g NaOH固体
II.现用中和滴定测定某盐酸的浓度,有关数据记录如下:
滴定序号 | 待测液体积(mL) | 所消耗烧碱标准液的体积(mL) | ||
滴定前 | 滴定后 | 消耗的体积 | ||
1 | 25.00 | 0.50 | 25.12 | 24.62 |
2 | 25.00 | / | / | / |
3 | 25.00 | 5.00 | 29.58 | 24.58 |
(3)应用______式滴定管盛装0.2500 mol/L烧碱标准液,锥形瓶中装有25.00mL待测盐酸溶液。
(4)如图表示第二次滴定时50 mL滴定管中前后液面的位置。该次滴定所用标准烧碱溶液体积为_________mL。

(5)根据所给数据,计算出该盐酸的物质的量浓度(注意保留合适的有效数字),c (HCl) = _____________。
(6)读数时,若滴定前仰视,滴定后俯视,则会使最终测定结果_________ (填“无影响”、“偏高”、“偏低”。下同);若装标准液的滴定管在装液前未用标准NaOH溶液润洗,会使最终测定结果_________。