题目内容
【题目】水合肼(N2H4·H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+ N2H4·H2O +NaCl
实验一:制备NaClO溶液。(实验装置如右图所示)
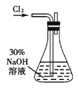
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有 (填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应的离子方程式是 。
(3)设计实验方案:用中和滴定原理测定反应后锥形瓶中剩余NaOH的浓度(实验提供的试剂:H2O2溶液、FeCl2溶液、0.10 mol·L-1盐酸、酚酞试液): 。
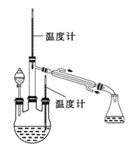
实验二:制取水合肼。(实验装置如右图所示)
(4)控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。分液漏斗中的溶液是 (填标号)。A.CO (NH2)2溶液 B.NaOH和NaClO混合溶液原因是: (用化学方程式表示)。
实验三:测定馏分中肼含量。
(5)称取馏分5.0g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.10mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O + 2I2= N2↑+ 4HI + H2O)
①滴定时,碘的标准溶液盛放在 (填“酸式”或“碱式”)滴定管中;本实验滴定终点的现象为 。
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质量分数为 。
【答案】(1)B、D(2)Cl2+ 2OH-= ClO-+ Cl-+ H2O(3)取一定量锥形瓶内混合溶液,加入适量的H2O2溶液后,滴加2~3滴酚酞试液,用 0.10mol·L-1盐酸滴定,记录消耗盐酸的量,重复上述操作2~3次。(其它合理答案给分)(4) B N2H4·H2O + 2NaClO = N2↑ + 3H2O + 2NaCl(5)酸式 溶液出现蓝色且半分钟内不消失(6)9%
【解析】
试题(3) 取一定量锥形瓶内混合溶液,加入适量的H2O2溶液后,滴加2~3滴酚酞试液,用 0.10mol·L-1盐酸滴定,记录消耗盐酸的量,重复上述操作2~3次,加入H2O2防止次氯酸根的在酸性条件下分解产生盐酸和氧气,干扰实验结果的测定。(4) B.NaOH和NaClO混合溶液,次氯酸根离子在酸性和加热条件下容易分解,所以分液漏斗中的液体是NaOH和NaClO混合溶液。(5) ①碱式滴定管上的橡皮管易被碘水腐蚀,故用酸式滴定管;②由化学方程式的三段式可知n(N2H4·H2O)=1/2n(I2)=1.8mol,故W(N2H4·H2O)=((1.8×10-3×50)/5)×100%=9%。

 阅读快车系列答案
阅读快车系列答案【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |




