题目内容
【题目】![]() 通入足量
通入足量![]() 稀溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入
稀溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入![]() 溶液,会产生白色沉淀,针对上述一系列变化过程中,下列说法中不正确的是
溶液,会产生白色沉淀,针对上述一系列变化过程中,下列说法中不正确的是
A.上述过程中,最终被还原的是![]()
B.从上述过程中可以得出结论,氧化性:![]() 稀
稀![]()
C.上述过程中,会产生一种无色无味的难溶于水的气体
D.若通入的![]() 完全反应,则同温同压下,
完全反应,则同温同压下,![]() 和逸出气体的体积为3:2
和逸出气体的体积为3:2
【答案】B
【解析】
SO2通入足量![]() 稀溶液中,根据溶液由棕色变为浅绿色,则Fe3+与SO2发生氧化还原化生成SO42-和Fe2+,该过程中发生反应SO2+ 2Fe3++2H2O = SO42-+ 2Fe2+-+ 4H+;立即又变为棕黄色,NO3-(H+)具有强氧化性使Fe2+转化为Fe3+,自身转化为一氧化氮气体,发生反应NO3-+ 3Fe2+-+ 4H+=3Fe3+ NO↑+2H2O,滴入
稀溶液中,根据溶液由棕色变为浅绿色,则Fe3+与SO2发生氧化还原化生成SO42-和Fe2+,该过程中发生反应SO2+ 2Fe3++2H2O = SO42-+ 2Fe2+-+ 4H+;立即又变为棕黄色,NO3-(H+)具有强氧化性使Fe2+转化为Fe3+,自身转化为一氧化氮气体,发生反应NO3-+ 3Fe2+-+ 4H+=3Fe3+ NO↑+2H2O,滴入![]() 溶液,会产生白色沉淀,SO42-证明未参与反应。故最终NO3-被还原。
溶液,会产生白色沉淀,SO42-证明未参与反应。故最终NO3-被还原。
A.由分析可知,最终NO3-被还原,SO2被氧化,A项错误;
B.由分析可知,且根据氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,则氧化性:HNO3>Fe3+>稀H2SO4,B项正确;
C.硝酸根离子在酸性环境下被还原为NO,无色无味的难溶于水,C项错误;
D.最终NO3-被还原,SO2被氧化,根据化合价升价守恒,↑2×n(SO2)=↓3×n(NO),n(SO2):n(NO)=3:2,同温同压下,体积比也为3:2,D项错误;
答案选B。

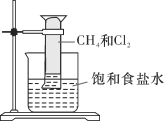
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |