题目内容
14.现有氯酸钾和二氧化锰的混合物60g,加热至固体不再减少时,剩余物质的质量为40.8g请计算(1)生成氧气的质量;
(2)原混合物中氯酸钾的质量;
(3)剩余固体中氯化钾的质量分数.
分析 (1)根据质量守恒定律,生成氧气的质量=反应前物质质量总和-反应后物质质量总和;
(2)利用氯酸钾受热分解的化学方程式和生成氧气的质量,列出比例式,就可计算出参与反应的氯酸钾质量;
(3)利用氯酸钾受热分解的化学方程式和生成氧气的质量,列出比例式,就可计算出剩余固体中氯化钾的质量.
解答 解:(1)生成氧气的质量=60g-40.8g=19.2g;答:生成氧气的质量19.2g;
(2)原来固体中氯酸钾的质量为x,剩余固体中氯化钾的质量为y
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
245 149 96
x y 19.2g
$\frac{245}{x}=\frac{96}{19.2g}$x=49g,答:原混合物中氯酸钾的质量49g;
(3)$\frac{149}{y}=\frac{96}{19.2g}$,解得:y=29.8g,剩余固体中氯化钾的质量分数$\frac{29.8g}{40.8g}$×100%≈73%,
答:剩余固体中氯化钾的质量分数73%.
点评 本题主要考查学生利用化学方程式和质量守恒定律解答问题的能力.解题的关键是根据质量守恒定律求出生成氧气的质量是解题的关键.

练习册系列答案
相关题目
4.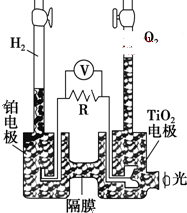 TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.下图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.下图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
 TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.下图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.下图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )| A. | TiO2电极上发生的反应为:2H++2e-═H2↑ | |
| B. | 该装置工作时,TiO2电极附近溶液的pH变大 | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置可以将光能转化为电能,同时也能将其转化为化学能 |
5.某同学用量筒量取液体时,将量筒放平稳,倒入液体,面对刻度线,第一次仰视凹液面最低处,读数为29ml;到出部分液体后,又俯视凹液面最低处,读数为11ml,该同学倒出的液体体积是( )
| A. | 18ml | B. | 大于18ml | C. | 小于18ml | D. | 无法判断 |
19.某有机物的结构简式为CH2=CHCH2CHO,下列对其化学性质的判断中不正确的是( )
| A. | 能被银氨溶液氧化 | |
| B. | 能使KMnO4酸性溶液褪色 | |
| C. | 1mol该有机物只能与1mol H2发生加成反应 | |
| D. | 1mol该有机物只能与1mol Br2发生加成反应 |
6.下列反应离子方程式书写正确的是( )
| A. | 钠和冷水反应:Na+2H2O═Na++OH-+H2↑ | |
| B. | 金属铝溶于氢氧化钠:Al+2OH-═AlO2-+H2↑ | |
| C. | 金属铝溶于盐酸中2Al+6H+═2Al3++3H2↑ | |
| D. | 铁跟稀盐酸反应:Fe+2H+═Fe3++H2↑ |
3.常温时,0.01mol•L-1某一元弱酸的电离常数Ka=10-6,则下列说法正确的是( )
| A. | 上述弱酸溶液的pH=4 | |
| B. | 加入NaOH溶液后,弱酸的电离平衡向右移动,K值增大 | |
| C. | 加入等体积0.01 mol•L-1 NaOH溶液后,所得溶液的pH=7 | |
| D. | 加入等体积0.01 mol•L-1 NaOH溶液后,所得溶液的pH<7 |
4.某气体样品可能由H2S、H2、Cl2、SO2、CO2和O2中的一种或几种组成,进行下列实验.已知试剂过量,反应完全,“→”表示气体流向.
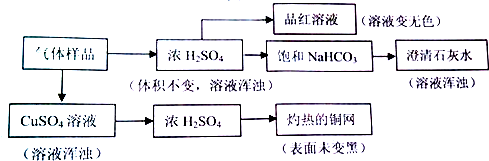
对上述实验结果,判断正确的是( )

对上述实验结果,判断正确的是( )
| A. | 能使品红溶液褪色,说明原气体样品中至少含有Cl2或SO2 | |
| B. | 灼热的铜网未变黑,说明原气体样品中一定不含有O2 | |
| C. | 澄清石灰水变浑浊,说明原气体样品中含有SO2,不能确定是否含有CO2 | |
| D. | 经过硫酸铜溶液,溶液变浑浊,说明原气体样品中含有H2S,则可排除SO2、Cl2的存在 |