题目内容
16.四种短周期元素的性质或结构信息如下表,下列结论中错误的是( )| 元素 | W | X | Y | Z |
| 性质或结构信息 | 单质制成的高压灯,发出的黄光透雾力强、射程远. | 工业上通过分离液态空气获得其单质.原子的最外层未达到稳定结构. | 单质常温常压下是气体,原子的M层差一个电子达稳定结构. | +2价阳离子的核外电子排布与氖原子相同. |
| A. | 上表中与W属于同一周期的元素是Z和Y | |
| B. | Z和Y形成的化合物属于离子化合物 | |
| C. | X的氢化物常温、常压下一定为液体 | |
| D. | Y单质为有色气体,具有强氧化性 |
分析 W单质制成的高压灯,发出的黄光透雾力强、射程远,则W为Na;X工业上通过分离液态空气获得其单质,原子的最外层未达到稳定结构,X可能为O,也可能为N元素;Y单质常温常压下是气体,原子的M层差一个电子达稳定结构,则Y为Cl元素;Z的+2价阳离子的核外电子排布与氖原子相同,则Z为Mg元素,以此解答该题.
解答 解:W单质制成的高压灯,发出的黄光透雾力强、射程远,则W为Na;X工业上通过分离液态空气获得其单质,原子的最外层未达到稳定结构,X可能为O,也可能为N元素;Y单质常温常压下是气体,原子的M层差一个电子达稳定结构,则Y为Cl元素;Z的+2价阳离子的核外电子排布与氖原子相同,则Z为Mg元素.
A.W为Na,Z为Mg,Y为Cl,三者均位于第三周期,故A正确;
B.Y为Cl,Z为Mg,二者形成的化合物MgCl2为离子化合物,故B正确;
C.X可能为O或N,形成的氢化物中H2O为液体,NH3为气体,故C错误;
D.Y为Cl,对应单质为Cl2,为黄绿色气体,具有强氧化性,故D正确,
故选C.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意Y元素不确定性,工业上通过分离液态空气可得到氧气和氮气.

练习册系列答案
相关题目
6.下列反应离子方程式书写正确的是( )
| A. | 钠和冷水反应:Na+2H2O═Na++OH-+H2↑ | |
| B. | 金属铝溶于氢氧化钠:Al+2OH-═AlO2-+H2↑ | |
| C. | 金属铝溶于盐酸中2Al+6H+═2Al3++3H2↑ | |
| D. | 铁跟稀盐酸反应:Fe+2H+═Fe3++H2↑ |
4.某气体样品可能由H2S、H2、Cl2、SO2、CO2和O2中的一种或几种组成,进行下列实验.已知试剂过量,反应完全,“→”表示气体流向.
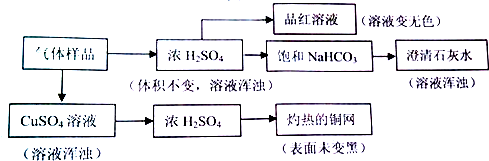
对上述实验结果,判断正确的是( )

对上述实验结果,判断正确的是( )
| A. | 能使品红溶液褪色,说明原气体样品中至少含有Cl2或SO2 | |
| B. | 灼热的铜网未变黑,说明原气体样品中一定不含有O2 | |
| C. | 澄清石灰水变浑浊,说明原气体样品中含有SO2,不能确定是否含有CO2 | |
| D. | 经过硫酸铜溶液,溶液变浑浊,说明原气体样品中含有H2S,则可排除SO2、Cl2的存在 |
1.下列反应既是吸热反应,又属于氧化还原反应的是( )
| A. | 铝片与稀盐酸的反应 | B. | Ba(OH)2.8H2O与NH4Cl的反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 稀盐酸与稀氢氧化钠溶液的反应 |
8.下列溶液中,不能鉴别SO2和CO2气体的是( )
①石灰水 ②H2S溶液 ③KMnO4溶液 ④溴水 ⑤酸化的Ba(NO3)2溶液 ⑥品红溶液.
①石灰水 ②H2S溶液 ③KMnO4溶液 ④溴水 ⑤酸化的Ba(NO3)2溶液 ⑥品红溶液.
| A. | 只有① | B. | ①⑤ | C. | ①②③⑤ | D. | ②③④⑤ |
5.NA为阿伏加德罗常数,下列有关说法正确的是( )
| A. | 常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4NA | |
| B. | 4℃时,18g2H216O中含有共用电子对数为2NA | |
| C. | 用金属铁、Cu片、稀硫酸组成原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA | |
| D. | 1mol N5+含有的电子数为34NA |
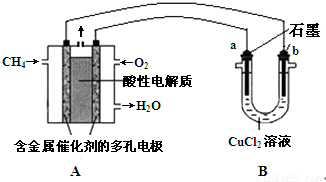
 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.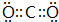 ,B与D形成的原子个数比为1:1的化合物的电子式是
,B与D形成的原子个数比为1:1的化合物的电子式是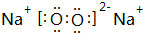 .
.