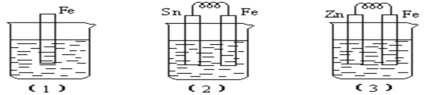
��Ŀ����
����Ŀ��Ӣ����ѧ��ϣ�����֣������Ҷ��������Һ�м����ʵ��ĵ�������(�������)���ڹ���ʱ��ʹˮ�ֽ���ͷ��������Ӷ�֤���������ͷ���CO2��ԭ�Dz�ͬ�Ĺ��̣����Թ�����õ��о�������ϸ�����档�÷�Ӧ����ʽΪ4Fe3++2H2O![]() 4Fe2++4H++O2���������й�ϣ����Ӧ˵��������ǣ� ��
4Fe2++4H++O2���������й�ϣ����Ӧ˵��������ǣ� ��
A. ˮ�ڹⷴӦ��������͵��ӹ���˫������
B. ��Ӧ����ҺpH��С
C. ���ɱ�״����11.2 L O2ʱ��Fe3+�õ�����Ϊ2NA
D. Ҷ���屾��������
���𰸡�D
��������
��Ӧ4Fe3++2H2O![]() 4Fe2++4H++O2���У�FeԪ�ػ��ϼ���+3�۽��͵�+2�ۣ�����ԭ��Fe3+Ϊ��������OԪ�ػ��ϼ���-2�����ߵ�0�ۣ���������H2OΪ��ԭ����Ҷ����Ϊ�������Դ˽��
4Fe2++4H++O2���У�FeԪ�ػ��ϼ���+3�۽��͵�+2�ۣ�����ԭ��Fe3+Ϊ��������OԪ�ػ��ϼ���-2�����ߵ�0�ۣ���������H2OΪ��ԭ����Ҷ����Ϊ�������Դ˽��
A���ɷ�Ӧ4Fe3++2H2O![]() 4Fe2++4H++O2����֪ˮ�ڹⷴӦ��������͵��ӹ���˫�����ã���A��ȷ��
4Fe2++4H++O2����֪ˮ�ڹⷴӦ��������͵��ӹ���˫�����ã���A��ȷ��
B����Ӧ����H+����ҺpH��С����B��ȷ��
C��OԪ�ػ��ϼ���-2�����ߵ�0�ۣ���ÿ���ɱ�״����11.2 L ��![]() =0.5molO2ת��0.5mol��4=2mol���ӣ���Fe3+�õ�����Ϊ2NA����C��ȷ��
=0.5molO2ת��0.5mol��4=2mol���ӣ���Fe3+�õ�����Ϊ2NA����C��ȷ��
D���ɷ���ʽ��֪Ҷ����Ϊ��������D����
�ʴ�ΪD��

����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ��������о�NOx��SO2�ȴ�����Ⱦ������ƴ���������Ҫ���塣
SO2���ŷ���Ҫ������ú��ȼ�գ���ҵ�ϳ��ð�ˮ���շ�����β���е�SO2����֪���չ�������ط�Ӧ���Ȼ�ѧ����ʽ���£�
��SO2(g)+NH3��H2O(aq)=NH4HSO3(aq) ��H1=akJ/mo1��
��NH3��H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ��H2=b kJ/mo1��
��2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ��H3=c kJ/mo1��
��Ӧ2SO2(g)+4NH3��H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O ��H
(1)��H =______kJ/mo1 (�ú�a��b��c�Ĵ���ʽ��ʾ)��
(2)���ڷ�Ӧ��C(s)+2NO(g)![]() N2(g)+CO2(g) ��H =-34.0kJ/mol����T1��ʱ��������������÷�Ӧ�ڲ�ͬʱ����ϸ����ʵ�Ũ�����£�
N2(g)+CO2(g) ��H =-34.0kJ/mol����T1��ʱ��������������÷�Ӧ�ڲ�ͬʱ����ϸ����ʵ�Ũ�����£�
ʱ�� Ũ�ȣ�mol/L�� | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
��0~10min�ڣ�CO2��ƽ����Ӧ�ٶ�v(CO2)=________��
��30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣻�����ϱ��е������жϸı������������_______(����ĸ)��
a.����һ�����Ļ���̿ b.ͨ��һ������NO
c.�ʵ���С��������� d.������ʵĴ���
(3)�û���̿��ԭ������NO���йط�ӦΪ��C(s)+2NO(g)![]() N2(g)+CO2(g) ��H =-34.0kJ/mo1����֪��һ���������ܱ������У�����������C��һ������NO���壬���NO��ת�������¶ȵı仯����ͼ��ʾ��
N2(g)+CO2(g) ��H =-34.0kJ/mo1����֪��һ���������ܱ������У�����������C��һ������NO���壬���NO��ת�������¶ȵı仯����ͼ��ʾ��

����ͼ��֪��1050Kǰ��Ӧ��NO��ת�������¶����߶�������ԭ��Ϊ________��
����1100Kʱ��CO2���������Ϊ________��
(4)Ϊ��������β���е��к�����Դ�������Ⱦ�����������װβ������װ�á��ھ���װ����CO��NO������Ӧ2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H =-746.8 kJ/mo1����������N2��CO2��ʵ���ã�v��=k����c2(NO)��c2(CO)��v��=k����c(N2)��c2(CO2) (k����k��Ϊ���ʳ�����ֻ���¶��й�)��
N2(g)+2CO2(g) ��H =-746.8 kJ/mo1����������N2��CO2��ʵ���ã�v��=k����c2(NO)��c2(CO)��v��=k����c(N2)��c2(CO2) (k����k��Ϊ���ʳ�����ֻ���¶��й�)��
�ٴﵽƽ��������¶ȣ�k������ı���____(����>����<������=��) k������ı�����
������2L���ܱ������г���2molCO��2molNO����һ���¶��´ﵽƽ��ʱ��CO��ת����Ϊ50%����![]() _______��
_______��