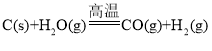题目内容
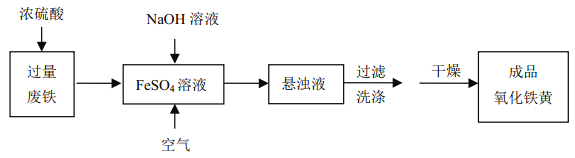
【题目】(1)过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态。如图是1molNO2与1mol CO恰好反应生成CO2和NO过程中的能量变化示意图。
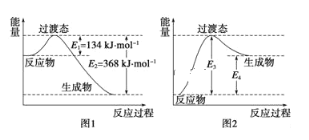
试写出NO2和CO反应的热化学方程式:____,该反应的活化能是____kJmol﹣1。
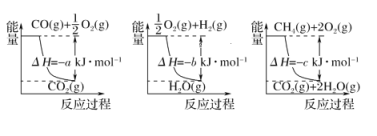
如图是某学生模仿如图画出的NO(g)+CO2(g)═NO2(g)+CO(g)的能量变化示意图。则图中E3=__kJmol﹣1,E4=__kJmol﹣1。
(2)在密闭容器中充入1mol H2和1mol I2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g) ![]() 2HI(g) ΔH<0。保持容器内气体压强不变,向其中加入1molN2,反应速率____(填“变大”、“变小”或“不变”),平衡____移动(填“向正反应方向”、“向逆反应方向”或“不”)。
2HI(g) ΔH<0。保持容器内气体压强不变,向其中加入1molN2,反应速率____(填“变大”、“变小”或“不变”),平衡____移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(3)T℃,向1 L密闭容器中加入1 mol HI(g),发生反应2HI![]() H2+I2,H2物质的量随时间的变化如图所示。
H2+I2,H2物质的量随时间的变化如图所示。
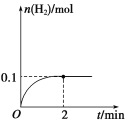
①该温度下,2HI(g) ![]() H2(g)+I2(g)的平衡常数K=____。
H2(g)+I2(g)的平衡常数K=____。
②相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则____是原来的2倍。
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
【答案】NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234kJ·mol-1 134kJ·mol-1 368 234 变小 不变 1/64 b
【解析】
(1)考查热化学反应方程式的书写,根据能量大小关系,判断出△H的方向,NO2与CO反应的方程式为NO2+CO=CO2+NO,根据图1,反应物的总能量大于生成物的总能量,该反应为放热反应,△H=(134-368)kJ·mol-1=-234kJ·mol-1,即热化学反应方程式为NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234kJ·mol-1;人们把能够发生有效碰撞的分子称为活化分子,把活化分子平均能量与反应物分子的平均能量之差称作活化能,即该反应的活化能是134kJ·mol-1。反应热等于正反应的活化能与逆反应的活化能之差。图2是图1的逆过程,因此E3=368kJ·mol-1,E4=234kJ·mol-1;
(2)考查非反应气体对化学反应速率的影响,以及对化学平衡移动的影响,N2不参与该反应,恒压状态下,通入1molN2,容器的体积增大,混合气体中各组分的浓度变小,化学反应速率变小,因为反应前后气体分子数之和相同,因此化学平衡不移动;
(3)考查化学平衡常数的计算、等效平衡,①化学平衡常数的计算,一般采用三段式法进行,2HI(g) ![]() H2(g)+I2(g)
H2(g)+I2(g)
起始:1 0 0
变化:0.2 0.1 0.1
平衡:0.8 0.1 0.1 容器的体积为1L,HI、H2、I2物质的量浓度分别是0.8mol·L-1、0.1mol·L-1、0.1mol·L-1,依据化学平衡常数的表达式,K=![]() =
=![]() =1/64;
=1/64;
②a、化学平衡常数只受温度的影响,温度不变,因此该反应化学平衡常数保持不变,故a不符合题意;
b、该反应前后气体分子数之和相等,恒温恒容下,该平衡与原平衡互为等效平衡,因此HI的平衡浓度应为原来的2倍,故b符合题意;
c、开始时加入HI的物质的量是原来的2倍,相当于在原来基础上增大压强,化学反应速率加快,达到平衡的时间变小,故c不符合题意;
d、根据b选项分析,两个平衡体系为等效平衡,H2的体积分数应是相等,故d不符合题意。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】一定温度下,在三个体积均为1.0 L 的恒容密闭容器中发生反应:2A(g)![]() B(g)+C(g) ΔH
B(g)+C(g) ΔH
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
A(g) | B(g) | C(g) | ||
Ⅰ | 387 | 0. 20 | 0. 080 | 0. 080 |
Ⅱ | 387 | 0. 40 | ||
Ⅲ | 207 | 0. 20 | 0. 090 | 0. 090 |
下列说法不正确的是
A. 该反应的正反应为ΔH<0
B. 207℃,K=4
C. 达到平衡时,容器Ⅰ中的A体积分数与容器Ⅱ中的相同
D. 容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的短
【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )

选项 | W | X |
A | 稀硫酸 | Na[Al(OH)4]溶液 |
B | 稀硝酸 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | Cl2 | Fe |
A.AB.BC.CD.D
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
1 | ||||||||||||||||||
2 | A | B | C | |||||||||||||||
3 | D | E | F | G | H | I | J | K | ||||||||||
4 | M | |||||||||||||||||
(1)在上表用字母标出的12种元素中,化学性质最不活泼的是____(用元素符号表示,下同),属于过渡元素的是___(该空格用表中的字母表示)。
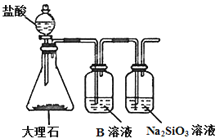
(2)为比较元素A和G的非金属性强弱,用下图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_____,能说明A和G非金属性强弱的化学方程式是______。
(3)J的氢化物的电子式为____,最高价氧化物对应的水化物的化学式为_________。