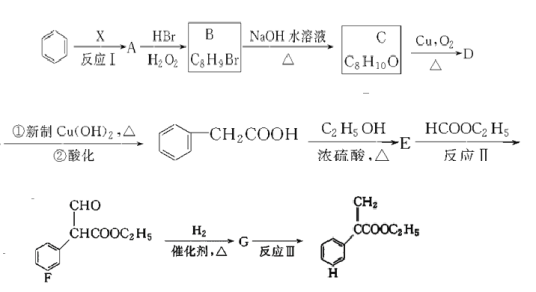
��Ŀ����
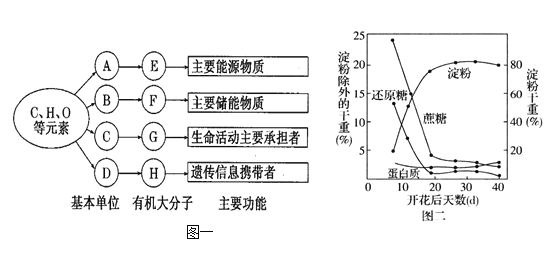
����Ŀ����֪��I2��ˮ���ܽ�Ⱥ�С����KI��Һ���ܽ����������I2��KI��Һ�д�������ƽ�⣺I2(aq)��I��(aq)![]() I3��(aq)����ò�ͬ�¶��¸÷�Ӧ��ƽ�ⳣ������ͼ��ʾ������˵����ȷ���ǣ�������
I3��(aq)����ò�ͬ�¶��¸÷�Ӧ��ƽ�ⳣ������ͼ��ʾ������˵����ȷ���ǣ�������
A. ��ӦI2(aq)��I-(aq)![]() I3 -(aq)�Ħ�H>0
I3 -(aq)�Ħ�H>0
B. ���ø÷�Ӧ���Գ�ȥ����������ĵⵥ��
C. ������ƽ����ϵ�м���CCl4��ƽ�ⲻ�ƶ�
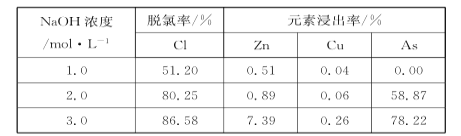
D. 25��ʱ��������ƽ����ϵ�м�������KI���壬ƽ�ⳣ��KС��680
���𰸡�B
��������
A����ͼ�����ݿ�֪���¶�Խ����ƽ�ⳣ��ԽС��˵�������¶�ƽ�����淴Ӧ�����ƶ���������Ӧ����Ϊ���ȷ�Ӧ������H��0����A����B����������ˮ�����ⵥ����I-�γ�I3-������ˮ�����Դﵽ��ȥ�������Ŀ�ģ���B��ȷ��C������CCl4����������CCl4������ˮ�е��Ũ�ȱ�С��ƽ�������ƶ�����C����D������KI���壬������Ũ������ƽ�������ƶ�����ƽ�ⳣ��ֻ���¶�Ӱ�죬�����ʵ�Ũ���أ���������KI���壬ƽ�ⳣ��K���䣬��D����ѡB��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ����8.12�����۱�ը����һ�������軯��й¶���軯�����������ˮ���о綾�������ˮ��Ⱦ��Ϊ�����Ӷ��軯����˽⣬ͬѧ�Dz������Ͻ���ѧϰ��̽����
̽���軯������ʣ���֪��������ĵ���ƽ�ⳣ�����±���
���� | HCOOH | HCN | H2CO3 |
25������ƽ�ⳣ�� | Ki=1.77��10��4 | Ki=5.0��10��10 | Ki1=4.3��10��7 Ki2=5.6��10��11 |
��1��NaCN��Һ�ʼ��Ե�ԭ����________________________���������ӷ���ʽ��ʾ��
��2����ͼ��ʾ�����£�ϡ��HCOOH��HCN�������ϡ��Һʱ����ҺpH���ˮ���ı仯������˵����ȷ����_________

A����ͬŨ�ȵ�HCOONa��NaCN�Ļ����Һ�У�������Ũ�ȵĴ�С��ϵ�ǣ�c��Na+����c��CN������c��HCOO������c��OH������c��H+��
B����NaCN��Һ��ͨ������������̼�����ӷ���ʽΪ��CN��+CO2+H2O=HCN+CO32��
C��ͼ����a�������Ũ��С��b�������Ũ��
D��c����Һ�ĵ����Ա�a����Һ�ĵ�������
��3��H2O2������ɫ�������������ƣ�Ҳ������ˮ�е��軯���KCN���������·�Ӧʵ�֣�KCN+H2O2+H2O�TA+NH3������������A�Ļ�ѧʽΪ_____��
��4�������������ӽ��H+����������ǿ����______________________________________��
A. HCOO- B. CN- C. CO32- D.HCO3-