题目内容
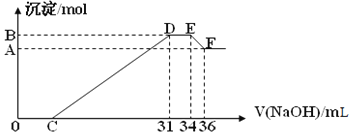
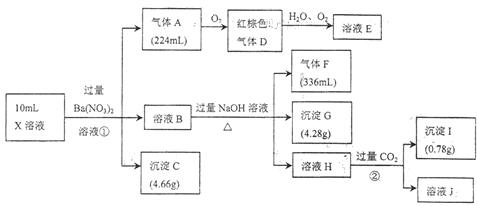
【题目】某强酸性溶液![]() 含有Al3+、NH4+、Fe2+、Fe3+、:CO32-、SiO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下测定)如下
含有Al3+、NH4+、Fe2+、Fe3+、:CO32-、SiO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下测定)如下
(1)步骤①中生成气体![]() 的离子方程式:________________________。
的离子方程式:________________________。
(2)步骤②生成沉淀Ⅰ的离子方程式:________________________。
(3)一般用铁氰化钾溶液检验溶液中是否存在______离子,请写出涉及的离子方程式:__________________;请设计实验,检验溶液![]() 中是否存在
中是否存在![]() :__________________。
:__________________。
(4)![]() 溶液中______(填“含”或“不含”)
溶液中______(填“含”或“不含”)![]() ,
,![]() ______
______![]() (若填不含,则不需计算)
(若填不含,则不需计算)
(5)通过上述实验,溶液中除![]() 外,一定存在的离子是____________;一定不存在的离子是____________。
外,一定存在的离子是____________;一定不存在的离子是____________。
(6)若测得![]() 溶液中
溶液中![]() ,则
,则![]() 溶液中
溶液中![]() ______
______![]() 。
。
【答案】3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O AlO2-+CO2+H2O=Al(OH)3↓+HCO3- Fe2+ 3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓ 取样,向溶液中加入硝酸酸化的硝酸银,若出现白色沉淀,则含有Cl- 含 1 Al3+、NH4+、Fe2+、SO42-、Fe3+、Cl- CO32-、SiO32-、NO3- 14.5
【解析】
强酸性溶液中一定不含CO32-、SiO32-,NO3-与Fe2+不能同时存在;由转化关系可知,X溶液中加入过量硝酸钡溶液,反应生成气体、沉淀和溶液,则溶液中一定含还原性离子Fe2+,不含NO3-,则气体A为NO、D为NO2、E为HNO3,溶液B中一定含有Fe3+,由得失电子数目守恒可知,溶液中Fe2+的物质的量为0.03mol;沉淀C为硫酸钡,则溶液中一定含SO42-,由硫酸钡的质量可知溶液中SO42-的物质的量为0.02mol;B溶液和过量氢氧化钠反应生成气体、沉淀和溶液则原溶液中一定含NH4+,生成的沉淀G是Fe(OH)3,气体F为NH3,由NH3的体积可知溶液中NH4+的物质的量为0.015mol,由Fe(OH)3的质量可知溶液B中Fe3+的物质的量为0.04mol,则原溶液中Fe3+的物质的量为0.01mol;由溶液H通入过量二氧化碳生成沉淀可知溶液H中含有AlO2-,则原溶液中一定含有Al3+,沉淀J为Al(OH)3,由Al(OH)3的质量可知溶液B中Al3+的物质的量为0.01mol;由电荷守恒可知,原溶液中一定含有Cl-,综上可知,原溶液中一定含有Al3+、NH4+、Fe2+、SO42-、Fe3+、Cl-,一定不含CO32-、SiO32-、NO3-。
(1)步骤①的反应为为在强酸性溶液中加入过量硝酸钡,钡离子和硫酸根离子反应生成硫酸钡沉淀,亚铁离子具有还原性,硝酸具有氧化性,酸性条件下,亚铁离子与硝酸根发生氧化还原反应生成三价铁离子、一氧化氮和水,则生成一氧化氮的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(2)步骤②的反应为过量二氧化碳和偏铝酸钠容易的反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:AlO2-+CO2+H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+H2O=Al(OH)3↓+HCO3-;
(3)铁氰化钾溶液与亚铁离子反应生成蓝色沉淀,反应的离子方程式为3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓;检验溶液B中是否含有Cl-,应选用酸化的硝酸银溶液,具体操作为取样,向溶液中加入硝酸酸化的硝酸银,若出现白色沉淀,则含有Cl-,故答案为:Fe2+;3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓;取样,向溶液中加入硝酸酸化的硝酸银,若出现白色沉淀,则含有Cl-;
(4)由题意NO的体积为224mL,则由由得失电子数目守恒可知,溶液中Fe2+的物质的量为0.03mol,由Fe(OH)3的质量为4.28g,可知溶液B中Fe3+的物质的量为0.04mol,则原溶液中Fe3+的物质的量为0.01mol,物质的量浓度为1mol/L,故答案为:含;1;
(5)通过上述分析可知,溶液中除H+外,原溶液中一定含有Al3+、NH4+、Fe2+、SO42-、Fe3+、Cl-,一定不含CO32-、SiO32-、NO3-,故答案为:Al3+、NH4+、Fe2+、SO42-、Fe3+、Cl-;CO32-、SiO32-、NO3-;
(6)通过上述分析可知,原溶液中含有0.01molAl3+、0.015molNH4+、0.03molF2+、0.02molSO42-、0.01molFe3+,若溶液中c(H+)为5 mol/L,H+的物质的量为0.05mol,由电荷守恒可知n(Cl-)=0.01mol×3+0.015mol×1+0.03mol×2+0.01mol×3+0.05×1—0.02mol×2=0.145mol,则c(Cl-)为14.5 mol/L,故答案为:14.5。

【题目】(1)无机化合物可根据其组成和性质进行分类:
ⅰ、下图所示的物质分类方法名称是________。
ⅱ、以Na、K、H、O、C、S中任意两种或三种元素组成合适的物质,分别填在下表②③⑥的后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学式 | ①HCl ② __ | ③ __ ④ Ba(OH)2 | ⑤ Na2CO3 ⑥ ___ | ⑦ CO2 ⑧ H2O |
ⅲ、 写出⑦通入到过量的④溶液中的离子方程式:_________。
ⅳ、 实验室检验气态⑧的方法是___________。
(2)某无色透明溶液,跟金属铝反应放出H2,判断下列离子:Mg2+、Ba2+、Cu2+、H+、Ag+、SO42-、SO32-、OH-、HCO3-、NO3-,哪种离子能大量存在于此溶液中。
ⅰ、 生成Al3+时,原无色透明溶液能够大量存在的离子有_______。
ⅱ、生成AlO2-时,原无色透明溶液能够大量存在的离子有_____。