题目内容
【题目】下列装置所示的实验中,能达到实验目的的是( )
|
|
A. 制备 | B. 比较 |
|
|
C. 铝热法制备少量铁单质 | D. 排水法收集氢气 |
A. AB. BC. CD. D
【答案】C
【解析】
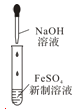
A项、氢氧化亚铁易被空气中的氧气氧化,制备氢氧化亚铁时,应将胶头滴管插入液面下,防止空气中氧气进入溶液氧化产生的氢氧化亚铁,故A错误;
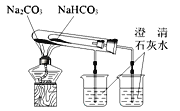
B项、较高温度下碳酸钠受热不分解,较低温度下碳酸氢钠受热分解,则比较碳酸钠和碳酸氢钠热稳定性时,直接加热的大试管中应盛放碳酸钠,间接加热的小试管中盛放碳酸氢钠,故B错误;
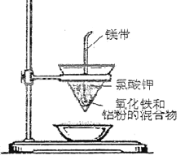
C项、铝具有较强的还原性,高温下能与氧化铁发生置换反应生成氧化铝和铁,故C正确;
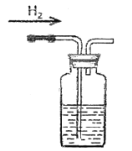
D项、排水法收集氢气时,氢气应从短管通入,故D错误;
故选C。

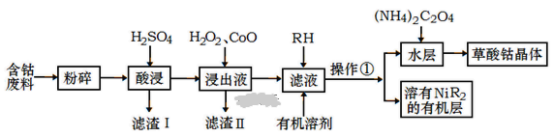
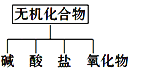
【题目】(1)无机化合物可根据其组成和性质进行分类:
ⅰ、下图所示的物质分类方法名称是________。
ⅱ、以Na、K、H、O、C、S中任意两种或三种元素组成合适的物质,分别填在下表②③⑥的后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学式 | ①HCl ② __ | ③ __ ④ Ba(OH)2 | ⑤ Na2CO3 ⑥ ___ | ⑦ CO2 ⑧ H2O |
ⅲ、 写出⑦通入到过量的④溶液中的离子方程式:_________。
ⅳ、 实验室检验气态⑧的方法是___________。
(2)某无色透明溶液,跟金属铝反应放出H2,判断下列离子:Mg2+、Ba2+、Cu2+、H+、Ag+、SO42-、SO32-、OH-、HCO3-、NO3-,哪种离子能大量存在于此溶液中。
ⅰ、 生成Al3+时,原无色透明溶液能够大量存在的离子有_______。
ⅱ、生成AlO2-时,原无色透明溶液能够大量存在的离子有_____。
【题目】温度为T时,在三个容积均为1L的恒容密闭容器中仅发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
容器 编号 | 容器类型 | 起始物质的量 / mol | 平衡时SO3的物质的量 / mol | ||
SO2 | O2 | SO3 | |||
I | 恒温恒容 | 2 | 1 | 0 | 1.8 |
II | 恒温恒压 | 2 | 1 | 0 | a |
III | 绝热恒容 | 0 | 0 | 2 | b |
A. 容器I中SO2的转化率小于容器II中SO2的转化率
B. 容器II的平衡常数大于容器III中的平衡常数
C. 平衡时SO3的物质的量:a>1.8、b>1.8
D. 若起始时向容器I中充入0.10 mol SO2(g)、0.20mol O2(g)和2.0 mol SO3(g),则此时v正<v逆