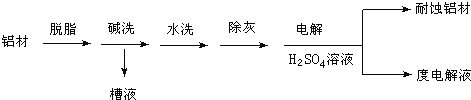
题目内容
【题目】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是_____,X和Y中电负性较大的是__(填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
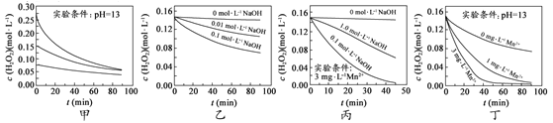
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是_________(填离子符号)。
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是____________。
【答案】1s22s22p63s1或[Ne]3s1 Cl H2S分子间不存在氢键,H2O分子间存在氢键 平面三角形 Na+ K2Cr2O7+3H2O2+ 4H2SO4=K2SO4+Cr2(SO4)3+3O2↑+7H2O
【解析】
M元素的2p电子数是2s的2倍,故价电子排布应为2s22p4,M为氧元素。R的原子序数比氧大,又是短周期金属,故只能是第三周期。第三周期最活泼的金属是钠。X与M的化合物,引起酸雨,只有可能是二氧化硫或氮氧化物。但是X的原子序数比氧大,故X只能是硫元素。Y的原子序数比X大,又是短周期元素,只能是氯元素。Z的最高价含氧酸的钾盐是橙色,这是重铬酸盐的典型颜色。题目中关于4s、3d轨道半充满的描述,也能推出Z是铬元素(3d54s1)。
(1)钠元素的基态电子排布为1s22s22p63s1,同周期元素从左到右电负性增大,Cl的电负性比S大。
(2)H2O之间有氢键,而H2S之间没有氢键。分子间氢键会导致化合物熔沸点升高。
(3)对于SO3分子,价电子对数为3,孤电子对数为![]() ,所以分子应该是平面三角形。
,所以分子应该是平面三角形。
(4)R2M为Na2O。晶胞中黑球全部在晶胞内部,故有8个,白球有![]() 个,二者比例为2:1。故黑球为Na+。
个,二者比例为2:1。故黑球为Na+。
(5)水的化学性质稳定,不会与重铬酸钾反应,被氧化的M的氢化物只能是H2O2,氧化产物是O2。根据题目,还原产物中Cr为+3价,反应又在稀硫酸中进行,故还原产物为Cr2(SO4)3。根据元素守恒,另两个产物是K2SO4和H2O。该反应的化学方程式是K2Cr2O7+3H2O2+ 4H2SO4 =K2SO4+Cr2(SO4)3+3O2↑+7H2O。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案【题目】(1)无机化合物可根据其组成和性质进行分类:
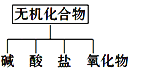
ⅰ、下图所示的物质分类方法名称是________。
ⅱ、以Na、K、H、O、C、S中任意两种或三种元素组成合适的物质,分别填在下表②③⑥的后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学式 | ①HCl ② __ | ③ __ ④ Ba(OH)2 | ⑤ Na2CO3 ⑥ ___ | ⑦ CO2 ⑧ H2O |
ⅲ、 写出⑦通入到过量的④溶液中的离子方程式:_________。
ⅳ、 实验室检验气态⑧的方法是___________。
(2)某无色透明溶液,跟金属铝反应放出H2,判断下列离子:Mg2+、Ba2+、Cu2+、H+、Ag+、SO42-、SO32-、OH-、HCO3-、NO3-,哪种离子能大量存在于此溶液中。
ⅰ、 生成Al3+时,原无色透明溶液能够大量存在的离子有_______。
ⅱ、生成AlO2-时,原无色透明溶液能够大量存在的离子有_____。
【题目】温度为T时,在三个容积均为1L的恒容密闭容器中仅发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
容器 编号 | 容器类型 | 起始物质的量 / mol | 平衡时SO3的物质的量 / mol | ||
SO2 | O2 | SO3 | |||
I | 恒温恒容 | 2 | 1 | 0 | 1.8 |
II | 恒温恒压 | 2 | 1 | 0 | a |
III | 绝热恒容 | 0 | 0 | 2 | b |
A. 容器I中SO2的转化率小于容器II中SO2的转化率
B. 容器II的平衡常数大于容器III中的平衡常数
C. 平衡时SO3的物质的量:a>1.8、b>1.8
D. 若起始时向容器I中充入0.10 mol SO2(g)、0.20mol O2(g)和2.0 mol SO3(g),则此时v正<v逆