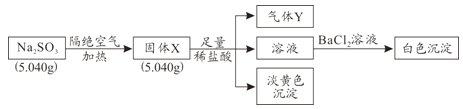
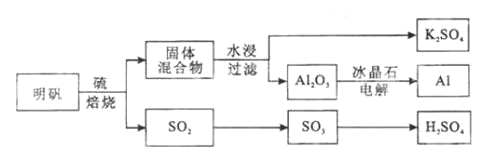
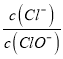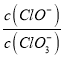题目内容
【题目】铝是重要的金属材料,铝土矿![]() 主要成分是
主要成分是![]() 和少量的
和少量的![]() 、
、![]() 杂质
杂质![]() 是工业上制取铝的原料.实验室模拟工业上以铝土矿为原料制取
是工业上制取铝的原料.实验室模拟工业上以铝土矿为原料制取![]() 和铵明矾晶体
和铵明矾晶体![]() 的工艺流程如图所示:
的工艺流程如图所示:
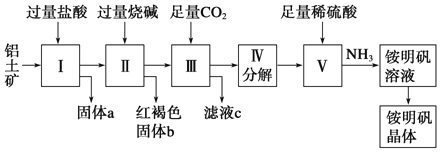
请回答下列问题:
![]() 固体a的化学式为______,Ⅲ中反应的离子方程式为______。
固体a的化学式为______,Ⅲ中反应的离子方程式为______。
![]() 由Ⅴ制取铵明矾溶液的化学方程式为______,从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、______
由Ⅴ制取铵明矾溶液的化学方程式为______,从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、______![]() 填操作名称
填操作名称![]() 。
。
![]() 若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。
若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。
若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中的![]() 和
和![]() 的物质的量之比为______。
的物质的量之比为______。
【答案】![]()
![]()
![]() 过滤洗涤
过滤洗涤 ![]() :10
:10
【解析】
铝土矿用盐酸溶解,Al2O3、Fe2O3反应得到AlCl3、FeCl3,SiO2不与盐酸反应,过滤得到固体a为SiO2,滤液中含有AlCl3、FeCl3及剩余的HCl,再加入过量的烧碱,反应得到氢氧化铁沉淀、偏铝酸钠、氯化钠,过滤,红褐色沉淀b为氢氧化铁,溶液中含有偏铝酸钠、氯化钠及剩余的NaOH,通入过量的二氧化碳,反应生成氢氧化铝沉淀与碳酸氢钠,过滤,滤液c中含有氯化钠、碳酸氢钠,将沉淀加热分解得到氧化铝,用硫酸溶解得到硫酸铝溶液,再通入氨气,得到铵明矾溶液,最后经过蒸发浓缩、冷却结晶、过滤等操作得到铵明矾晶体。
![]() 铝土矿中
铝土矿中![]() 和
和![]() 能溶于盐酸,
能溶于盐酸,![]() 不溶于盐酸,所以固体a的化学式为
不溶于盐酸,所以固体a的化学式为![]() ,
,![]() 溶于烧碱生成
溶于烧碱生成![]() 溶液,在其中通入
溶液,在其中通入![]() 生成
生成![]() 沉淀,
沉淀,
离子方程式为:![]() ;
;
![]() 分解生成
分解生成![]() ,
,![]() 与稀硫酸、氨气反应生成铵明矾溶液:
与稀硫酸、氨气反应生成铵明矾溶液:![]() ,从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、过滤洗涤;
,从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、过滤洗涤;
![]() 设制得的
设制得的![]() 和
和![]() 的物质的量都是1mol,则
的物质的量都是1mol,则![]() 共3mol,
共3mol,![]() 共5mol,根据
共5mol,根据![]() 和
和![]() 守恒原理可得,加入
守恒原理可得,加入![]() 和
和![]() 的物质的量之比为
的物质的量之比为![]() :
:![]() :10。
:10。

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
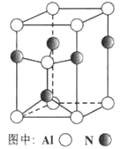
单元全能练考卷系列答案【题目】A~H八种短周期主族元素在周期表中的相对位置如图所示,已知C元素形成的单质有“国防金属”的美誉,![]() 的最高化合价与最低化合价之和为2。回答下列问题:
的最高化合价与最低化合价之和为2。回答下列问题:
A | …… | D | E | F | ||
B | C | …… | G | H |
(1)D元素在周期表中的位置为________________。
(2)上述元素所形成的气态单质中能用于饮用水消毒的有________________(填化学式)。
(3)B的单质在F的单质中燃烧的火焰颜色为________。
(4)C元素的单质可以在D和F形成的一种气态化合物中燃烧,写出该反应的化学方程式_____