题目内容
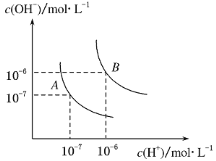
【题目】(1)水的电离平衡曲线如右图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示100 ℃时水的电离达平衡时的离子浓度。则100 ℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=________mol·L-1,KW(25 ℃)________KW(100 ℃)(填“>”、“<”或“=”)。
(2)25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
已知如表数据。
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
(3)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为____ ___。(填化学式)
(4)25 ℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)。
(5)向NaCN溶液中通入少量CO2,反应的化学方程式为________________________。
【答案】
(1)1×10-6;<;
(2)促进
(3)Na2CO3>NaCN>CH3COONa;
(4)>
(5)NaCN+H2O+CO2=HCN+NaHCO3
【解析】
试题分析:(1)25℃时纯水中c(H+)=c(OH-)=10-7 mol/L,Kw=c(H+)c(OH-)=10-14 ,当温度升高到100℃,纯水中c(H+)=c(OH-)=10-6 mol/L,Kw=c(H+)c(OH-)=10-12 ;100℃时1molL-1 的NaOH溶液中Kw=c(H+)c(OH-)=10-12 ;c(OH-)=1mol/L,水电离出的c(H+)=1×10-12;水的电离时吸热过程,加热促进电离氢离子浓度和氢氧根离子浓度增大,Kw增大,所以Kw(25℃)<Kw(100℃),故答案为:1×10-12;<;
(2))NH4Cl固体溶解后溶液中铵根离子水解生成一水合氨和氢离子,溶液呈酸性,水的电离被促进,故答案为:促进;
(3)依据图表数据分析,醋酸电离常数大于氰酸大于碳酸氢根离子,所以等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度等浓度的Na2CO3溶液>NaCN溶液>CH3COONa溶液,溶液pH为Na2CO3溶液的>NaCN溶液的>CH3COONa溶液的;故答案为:Na2CO3>NaCN>CH3COONa;
(4)等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,c(H+)<c(OH-)依据溶液中电荷守恒c(H+) + c(Na+) = c(OH-) + c(CH3COO-),c(Na+) > c(CH3COO-);故答案为:>;
(5)向NaCN溶液中通入少量CO2 ,H2CO3酸性大于HCN大于HCO3-,所以反应生成氰酸和碳酸氢钠,不能生成二氧化碳,反应的化学方程式为:NaCN+H2O+CO2=HCN+NaHCO3;故答案为:NaCN+H2O+CO2=HCN+NaHCO3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)已知: ![]()
![]()
![]()
则煤气化主要反应![]() ________________
________________
(2)已知![]() 的正反应速率为
的正反应速率为![]() ,逆反应速率为
,逆反应速率为![]() ,k为速率常数。2500K时,
,k为速率常数。2500K时, ![]() ,则该温度下的反应平衡常数K=_________________ 。
,则该温度下的反应平衡常数K=_________________ 。
(3)甲醇制甲醚的有关反应为: ![]() 一定温度下,在三个容积均为1.0 L的恒容密闭容器中发生该反应。
一定温度下,在三个容积均为1.0 L的恒容密闭容器中发生该反应。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
CH3OH | CH3OCH3 | H2O | ||
I | 387 | 0. 20 | x | |
II | 387 | 0. 40 | y | |
Ⅲ | 207 | 0. 20 | 0. 090 | 0. 090 |
![]() ________________.
________________.
②已知![]() 时该反应的化学平衡常数K=4。该温度下,若起始时向容器I中充入0.10mol
时该反应的化学平衡常数K=4。该温度下,若起始时向容器I中充入0.10mol ![]() ,则反应将向_________(填“正”或“逆”)反应方向进行。
,则反应将向_________(填“正”或“逆”)反应方向进行。
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的措施为______________(填序号)
A.升高温度 B.其他条件不变,增加![]() 的物质的量
的物质的量
C.降低温度 D.保持其他条件不变,通入氖气
(4)为减少雾霾、降低大气中有害气体含量,研究机动车尾气中![]() 及
及![]() 的排放量意义重大。机动车尾气污染物的含量与空/燃比(空气与燃油气的体积比)的变化关系示意图如图所示:
的排放量意义重大。机动车尾气污染物的含量与空/燃比(空气与燃油气的体积比)的变化关系示意图如图所示:

①当空/燃比达到15后![]() 减少的原因可能是__________(填字母)。
减少的原因可能是__________(填字母)。
a.反应![]() 是吸热反应
是吸热反应
b.当空/燃比大干15后,燃油气燃烧放出的热量相应减少
②随空/燃比增大,CO和![]() 的含量减少的原因是______。
的含量减少的原因是______。