题目内容
已知盐酸参加的下列三个反应:
① CaCO3+2HCl=CaCl2+CO2↑+H2O
② Fe+2HCl=FeCl2+H2↑
③ MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)判断上述三个反应中属于氧化还原反应的是_________,其中盐酸作还原剂的是__________。
(2)上述反应说明盐酸具有_______性,______性,_______性。
(1)②③ ,③ (2)酸 , 氧化 ,还原(各1分)
解析试题分析:(1)有电子转移的化学反应是氧化还原反应,失电子化合价升高的反应物是还原剂。①CaCO3+2HCl=CaCl2+CO2↑+H2O中,各元素化合价都不变,所以不是氧化还原反应,为复分解反应;②Fe+2HCl=FeCl2+H2↑中,铁失电子化合价升高,盐酸中氢元素得电子化合价降低,所以该反应是氧化还原反应,盐酸作氧化剂;③MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O中锰元素得电子化合价降低,氯元素失电子化合价升高,所以该反应是氧化还原反应,且盐酸是还原剂,故答案为:②③;③。
MnCl2+Cl2↑+2H2O中锰元素得电子化合价降低,氯元素失电子化合价升高,所以该反应是氧化还原反应,且盐酸是还原剂,故答案为:②③;③。
(2)根据各反应酸中各元素化合价变化来确定其性质。通过(1)知,①中盐酸起酸作用,②中盐酸作氧化剂,③中盐酸作还原剂和酸性的作用,所以上述反应说明盐酸具有酸性、氧化性和还原性。
考点:考查氧化还原反应的判断以及盐酸在反应中作用的判断

合成氨和制备硝酸是两种重要的化工生产,重庆某化工厂将合成氨与制备硝酸进行连续生产。
(1)在某温度下体积为200 L的氨合成塔中,以分为单位的时间点上测得各物质的浓度(mol·L﹣1)如下表:
| | 0 min | l min | 2 min | 3 min | 4 min |
| N2 | 1.500 | 1.400 | 1.200 | c1 | c1 |
| H2 | 4.500 | 4.200 | 3.600 | c2 | c2 |
| NH3 | 0 | 0.200 | 0.600 | c3 | c3 |
根据表中数据得知0 min~2 min内N2的平均反应速率是_______,若3 min末N2的转化率为a,则此时H2的转化率为_______ (用含a的代数式表示)。
(2)今对合成氨反应进行如下研究:在容积均为10 L的a、b、c三个相同密闭容器中分别充入1 mol N2和3 mol H2,三个容器的反应温度分别为T1、T2、T3,在其他条件相同情况下,实验测得反应均进行到5 min时,NH3的体积分数如图所示。则下列说法正确的是_______。
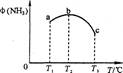
A.a、b、C三容器5 min时的正反应速率大小为:b>a>c
B.达到平衡时,a、b、c中N2转化率为a>b>c
C.5min时,a、b、c三容器中的反应均可能达到平衡状态。
D.将容器b中的平衡状态转变到容器c中的平衡状态,可采取的措施有升温或减压
(3)已知:N2(g)+O2(g)=2NO(g): △H=+180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=﹣905 kJ/mol
2H2(g)+O2(g)=2H2O(g); △H=﹣483.6 kJ/mol
则在该条件下,氨合成塔中所发生反应的热化学方程式为:____________________________;
(4)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,写出该反应的离子方程式:_________________________________________;
(5)取200 mL的硝酸恰好与32 g Cu2S完全反应,已知硝酸被还原成等物质的量的NO和NO2,另外还有CuSO4和Cu(NO3)2生成,则所得工业硝酸的浓度是_______mol·L﹣1。
(1)如图是课本中“四种基本反应类型与氧化还原反应的关系”图,“H2+CuO  Cu+H2O”反应属于图中的区域 (填序号)。下列反应中属于区域7的有 。
Cu+H2O”反应属于图中的区域 (填序号)。下列反应中属于区域7的有 。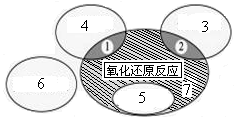
A.2H2+O2 2H2O 2H2O |
B.2NaHCO3 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
| C.Zn+H2SO4=ZnSO4+H2↑ |
D.CuO+CO Cu+CO2 Cu+CO2 |
O2、H2CrO4、Cr(OH)3、H2O、H2O2
已知:该反应中H2O2只发生如下过程:H2O2→O2。
①该反应中,发生还原反应的物质是 。
②写出该反应的化学方程式(不用配平)
_________+________ → ________+________+________
(3)3Cl2+8NH3
 N2+6NH4Cl
N2+6NH4Cl①用双线法表示该反应转移的电子数目和方向。
②该反应中,氧化剂与还原剂分子个数之比为 。
(4)在一定条件下,PbO2与Cr3+反应,产物是Cr2O72—和Pb2+。若与1molCr3+完全反应所需PbO2的物质的量为 。
碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O--KH(IO3)2+KCl+Cl2 ↑(未配平)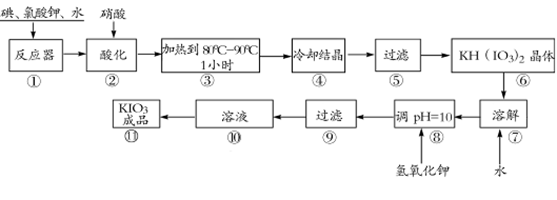
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同,请配平该反应的化学方程式:______________________________________________________________;
(2)步骤②中,用稀酸酸化的作用是____________________________________________;
不选稀盐酸的原因是 ;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为 ;
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是 。
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |