题目内容
已知硫氰(SCN)2为拟卤素,其分子及阴离子的性质与卤素性质相似。完成下列填空:将硫氰化钾溶液与氯化铁溶液混合,溶液变为血红色。
(1)写出该反应的化学方程式 。
将生成的血红色溶液分为四等份,进行如下实验(第四份是对照):
(2)第一份中加入少量的氯化钾固体,溶液的颜色 (填“会”或“不会”)加深。
(3)第二份中滴加入碘化钾溶液至过量,再加入四氯化碳,充分振荡,最终水层接近无色,四氯化碳层呈 色,写出该过程的离子方程式
。
向该溶液中滴加少量溴水,水溶液又变为血红色,则氧化性Br2 (SCN)2(填“大于”、“小于”或“无法确定”)。
(4)第三份中加入少量酸性高锰酸钾溶液,血红色褪去。完成并配平该反应的离子方程式。若含 mol高锰酸钾的溶液完全反应,转移电子2mol。
(1)FeCl3 + 3KSCN Fe(SCN)3 + 3KCl (1分)
Fe(SCN)3 + 3KCl (1分)
(2) 不会(1分)
(3) 紫色(1分) 2Fe3++2I-→2Fe2++I2 (1分) 无法确定(1分)
(4) 0.4mol (1分) 2MnO4-+10SCN-+16H+→2Mn2++5(SCN)2+8H2O (2分)
解析试题分析:
(1)硫氰化钾溶液与氯化铁溶液反应:FeCl3 + 3KSCN Fe(SCN)3 + 3KCl。
Fe(SCN)3 + 3KCl。
(2) 氯化钾对上述可逆反应不会有影响。
(3)碘单质溶于四氯化碳显紫色; 反应为:2Fe3++2I-→2Fe2++I2 ;
根据实验现象可知氧化性Br2>I2,但Br2与(SCN)2无法确定。
(4)反应为:2MnO4-+10SCN-+16H+→2Mn2++5(SCN)2+8H2O,根据反应可知2MnO4-共转移10电子,因此为0.4mol。
考点:考查元素及其化合物知识、氧化还原反应、化学平衡知识。

碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O--KH(IO3)2+KCl+Cl2 ↑(未配平)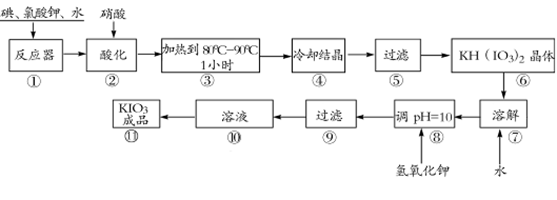
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同,请配平该反应的化学方程式:______________________________________________________________;
(2)步骤②中,用稀酸酸化的作用是____________________________________________;
不选稀盐酸的原因是 ;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为 ;
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是 。
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
(1)请完成该反应的离子方程式:
C + MnO4- + H+ — CO2↑+ Mn2+ + H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中。进行反应CO(g ) + H2O(g)  CO2(g) + H2(g)得到如下两组数据:
CO2(g) + H2(g)得到如下两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①实验1从开始到达到化学平衡时,以v(CO2)表示的反应速率为 。(精确到0.01)
②该反应为 (填“吸”或“放”)热反应,实验2中达平衡时 CO的转化率为 。
(3)在容积可变的密闭容器中发生反应:mA(g) + nB(g)
 pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
①当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左, 向右 ,不)
②当压强从5×105 Pa增加到1×106 Pa时,该反应平衡常数表达式为K= 。⑷在25℃下,向浓度为0.1mol·L-1的FeCl3溶液中逐滴加入氨水,调节溶液pH为 5时,溶液中c(Fe3+)为 mol/L 。(已知25℃时 Ksp[Fe(OH)3]=4×10-38)