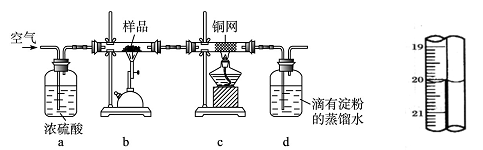
题目内容
为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示:
①3Fe NaNO2
NaNO2 5NaOH → 3Na2FeO2
5NaOH → 3Na2FeO2 H2O
H2O NH3↑
NH3↑
② Na2FeO2 NaNO2
NaNO2 H2O → Na2Fe2O4
H2O → Na2Fe2O4 NH3↑
NH3↑ NaOH
NaOH
③Na2FeO2 Na2Fe2O4
Na2Fe2O4 2H2O
2H2O Fe3O4
Fe3O4 4NaOH
4NaOH
(1)配平化学方程式②。
(2)上述反应①中还原剂为 ,被还原的是 。若有1mol Na2FeO2生成,则反应中有 mol电子转移。
(3)关于形成“发蓝”的过程,下列说法正确的是…………………………………………( )
| A.该生产过程不会产生污染 | B.反应③生成的四氧化三铁具有抗腐蚀作用 |
| C.反应①②③均是氧化还原反应 | D.反应①②中的氧化剂均为NaNO2 |
(1)6,1,5,3,1,7 (1分)
(2)Fe (1分) 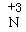 或+3价的N (1分) 2 (1分)
或+3价的N (1分) 2 (1分)
(3)BD (2分)
(4)反应③可逆,氢氧化钠浓度过大,平衡向逆反应方向移动 (2分)
解析试题分析:
(1)由化合价升降法配平,Na2FeO2 :Fe(+2)→Na2Fe2O4:Fe(+3) 2个Fe升高2;NaNO2:N(+3)→NH3 N(-3),N降低6 ,最小公倍数6,Na2FeO2 前填6 ;Na2Fe2O4前填3;NaNO2 和NH3前填1,其他观察法配平。
(2)1mol Na2FeO2变成Na2Fe2O4,化合价升高2,电子转移为2mol。
(3)A、有NH3 会产生污染,错误;B、生成Fe3O4,有致密的保护层,有抗腐蚀作用 ,正确;C、③不是氧化还原反应,错误;D 、NaNO2:N(+3)→NH3 N(-3),化合价降低,做氧化剂,正确。
考点:本题以生活常识为基础,考查氧化还原反应等知识。

 阅读快车系列答案
阅读快车系列答案碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O--KH(IO3)2+KCl+Cl2 ↑(未配平)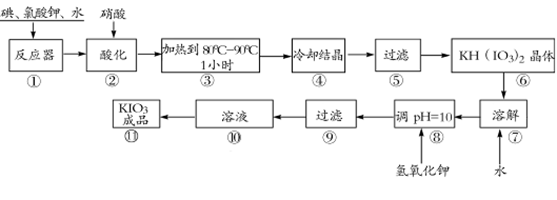
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同,请配平该反应的化学方程式:______________________________________________________________;
(2)步骤②中,用稀酸酸化的作用是____________________________________________;
不选稀盐酸的原因是 ;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为 ;
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是 。
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
某兴趣小组挤究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示: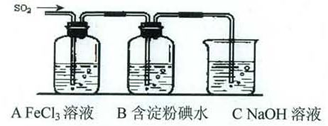
(1)SO2气体还原Fe3+反应的产物是_____________、_____________(填离子符号)。
(2)下列实验方案可以用于在实验室制取所需SO2的是____。
| A.Na2SO3溶液与HNO3 | B.Na2SO3固体与浓硫酸 |
| C.固体硫在纯氧中燃烧 | D.铜与热浓H2SO4 |
(4)如果有280 mL SO2气体(已折算为标态)进入C装置中,则C中50 mL NaOH溶液的浓度至少为_____________mol/L才能达到目的。
(5)在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是____,原因是_______________________________________。
(6)能表明I-的还原性弱于SO2的现象是_________________________________________,写出有关离子方程式:_______________________________________。
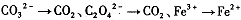 ,找出其中一个变化与“
,找出其中一个变化与“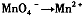 ”组成一个反应,写出该反应的离子方程式____ 。
”组成一个反应,写出该反应的离子方程式____ 。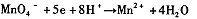
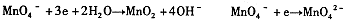 由此可知,高锰酸根离子(MnO—4)反应后的产物与 有关。
由此可知,高锰酸根离子(MnO—4)反应后的产物与 有关。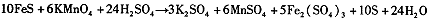
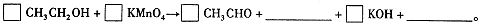


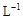 , 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20 、 lg5=0.7)
, 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20 、 lg5=0.7)