题目内容
5.几种短周期元素的原子半径及主要化合价见下表:| 元素代号 | M | Q | A | D | R | E | T |
| 原子半径/nm | 0.037 | 0.160 | 0.077 | 0.075 | 0.089 | 0.102 | 0.074 |
| 主要化 合价 | +1 | +2 | +4、+2 | +5、-3 | +2 | +6、-2 | -2 |
| A. | Q、R的单质与稀盐酸反应的剧烈程度Q<R | |
| B. | T、Q形成的简单离子核外电子数相同 | |
| C. | 化合物AM4、DM3、M2T的稳定性逐渐减弱 | |
| D. | 化合物M2T2、ET2均具有漂白性,且漂白原理相同 |
分析 在短周期元素中,Q、R化合价为+2价,处于ⅡA族,原子半径Q>R,故Q为Mg,R为Be;E和T的化合价都有-2价,处于ⅥA族,E的最高价为+6价,T无正价,E为S元素,T为O元素;A有+4价,处于ⅣA族,D有+5、-3价,处于VA族,原子半径均小于S,故A为碳元素、D为N元素;M有+1价,处于IA族,原子半径小于氮,故M为H元素,结合元素周期律与元素化合物知识解答该题.
解答 解:在短周期元素中,Q、R化合价为+2价,处于ⅡA族,原子半径Q>R,故Q为Mg,R为Be;E和T的化合价都有-2价,处于ⅥA族,E的最高价为+6价,T无正价,E为S元素,T为O元素;A有+4价,处于ⅣA族,D有+5、-3价,处于VA族,原子半径均小于S,故A为碳元素、D为N元素;M有+1价,处于IA族,原子半径小于氮,故M为H元素.
A.金属性Mg>Be,则Mg与酸反应越剧烈,则相同条件下单质与稀盐酸反应速率为Q>R,故A错误;
B.O2-核外有10个电子,Mg2+核外有10个电子,二者核外电子数相同,故B正确;
C.非金属性C<N<O,故氢化物稳定性CH4、NH3、H2O的稳定性逐渐增强,故C错误;
D.化合物H2O2、SO2均具有漂白性,前者利用其强氧化性,后者与有色物质化合为不稳定无色物质,二者漂白原理不相同,故D错误,
故选:B.
点评 本题考查元素位置结构和性质的关系及应用,题目难度中等,正确把握元素化合价、原子半径与元素性质的关系是解答该题的关键,注意元素周期律的递变规律的应用.

练习册系列答案
相关题目
15.下列分子中所有原子都满足最外层为8电子结构的是( )
①BeCl2 ②NCl3 ③PCl5 ④COCl2 ⑤SF6 ⑥XeF2 ⑦CS2 ⑧CH4 ⑨CF2Cl2⑩S2Cl2.
①BeCl2 ②NCl3 ③PCl5 ④COCl2 ⑤SF6 ⑥XeF2 ⑦CS2 ⑧CH4 ⑨CF2Cl2⑩S2Cl2.
| A. | ②④⑦⑧⑨⑩ | B. | ②④⑦⑨⑩ | C. | ③④⑦⑩ | D. | ④⑤⑦⑨⑩ |
16.下列关于乙醇在各种反应中断裂键的说法不正确的是( )


| A. | 乙醇与钠反应,键①断裂 | |
| B. | 乙醇在Ag催化作用下与O2反应,键①③断裂 | |
| C. | 乙醇完全燃烧时,只有①②键断裂 | |
| D. | 乙醇、乙酸和浓硫酸共热制乙酸乙酯,键①断裂 |
13.下列分子中所有原子都满足最外层8电子结构的是
①CO2 ②XeF6 ③PCl3 ④SO2 ⑤BF3 ⑥N2 ⑦P4 ⑧PCl5( )
①CO2 ②XeF6 ③PCl3 ④SO2 ⑤BF3 ⑥N2 ⑦P4 ⑧PCl5( )
| A. | ①③⑥⑦ | B. | ①④⑤ | C. | ①④⑥ | D. | ②③④⑤ |
10.化学与生产、生活密切相关.下列说法不正确的是( )
| A. | 乙烯可作水果的催熟剂 | B. | SO2可用于杀菌消毒 | ||
| C. | 2H和3H可用于制造氢弹 | D. | 裂化汽油可用作萃取剂 |
17.以下实验能获得成功的是( )
| A. | 要检验某溴乙烷中的溴元素,可以加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| B. | 用乙醇制取乙烯时所用温度计的位置与石油分馏时所用温度计的位置不同 | |
| C. | 用氨水清洗试管壁附着的银镜 | |
| D. | 制取乙炔时药品是电石和饱和食盐水,仪器用启普发生器 |
15.下列物质既可以做防腐剂,又可以做调味剂的是( )
| A. | 食盐 | B. | 纯碱 | C. | 甘氨酸 | D. | 味精 |
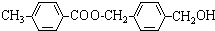 ,从A出发,可发生图示中的一系列反应.其中M属于高分子化合物,J和K互为同分异构体,N的产量可作为衡量一个国家石油化工发展水平的标志.
,从A出发,可发生图示中的一系列反应.其中M属于高分子化合物,J和K互为同分异构体,N的产量可作为衡量一个国家石油化工发展水平的标志.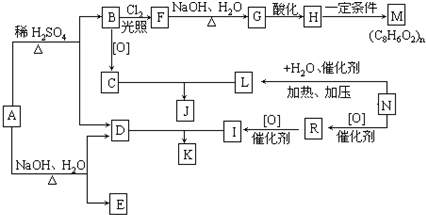
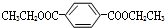 K
K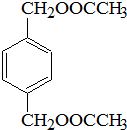
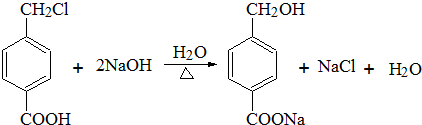 ;
;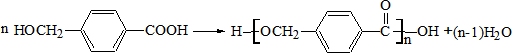 ;
;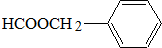 .
.