题目内容
7.表为元素周期表的一部分,请回答有关问题:| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ⑥ | ② | |||||
| 3 | ③ | ④ | ⑤ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
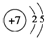 ,⑩的元素名称:溴
,⑩的元素名称:溴(2)③④⑤原子半径由大到小的顺序是Mg>Al>Si(填元素符号)
(3)表中最活泼的金属是K,非金属性最强的元素是F;(填写元素符号)
(4)表中能形成两性氢氧化物的元素是Al,写出该元素的氢氧化物与⑨的最高价氧化物对应水化物反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(5)用电子式表示③与⑥的化合物的形成过程:
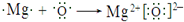 .
.
分析 由元素在周期表中的位置可知,①为N、②为F、③为Mg、④为Al、⑤为Si、⑥为O、⑦为Cl、⑧为Ar、⑨为K、⑩为Br.
(1)N原子核外有7个电子层,有个电子层各层电子数为2、5;
(2)同周期自左而右原子半径减小;
(3)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱;
(4)氢氧化铝是两性氢氧化物,⑨的最高价氧化物对应水化物为KOH,二者反应生成偏铝酸钾与水;
(5)③与⑥的化合物为MgO,由镁离子与氧离子构成.
解答 解:由元素在周期表中的位置可知,①为N、②为F、③为Mg、④为Al、⑤为Si、⑥为O、⑦为Cl、⑧为Ar、⑨为K、⑩为Br.
(1)N原子核外有7个电子层,有个电子层各层电子数为2、5,原子结构示意图为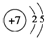 ,⑩为溴元素,故答案为:
,⑩为溴元素,故答案为: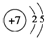 ;溴;
;溴;
(2)同周期自左而右原子半径减小,故原子半径:Mg>Al>Si,故答案为:Mg>Al>Si;
(3)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故表中金属性最强为K,非金属性最强的为F,故答案为:K;F;
(4)Al元素的氢氧化物--氢氧化铝是两性氢氧化物,⑨的最高价氧化物对应水化物为KOH,二者反应生成偏铝酸钾与水,离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al;Al(OH)3+OH-=AlO2-+2H2O;
(5)③与⑥的化合物为MgO,由镁离子与氧离子构成,用电子式表示其形成过程为: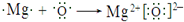 ,
,
故答案为: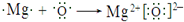 .
.
点评 本题考查元素周期表与元素周期律的综合应用,难度不大,侧重学生对基础知识的巩固,注意掌握电子式表示物质或化学键的形成.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
17.以下实验能获得成功的是( )
| A. | 要检验某溴乙烷中的溴元素,可以加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| B. | 用乙醇制取乙烯时所用温度计的位置与石油分馏时所用温度计的位置不同 | |
| C. | 用氨水清洗试管壁附着的银镜 | |
| D. | 制取乙炔时药品是电石和饱和食盐水,仪器用启普发生器 |
18.从化学角度分析,生活中的下列做法不正确的是( )
| A. | 用温水泡加酶洗衣粉 | |
| B. | 长期保存食用油应隔绝空气 | |
| C. | 使用加碘(KIO3)食盐时避免高温 | |
| D. | 可以在装饰材料中大量添加甲醛、苯等物质 |
15.下列物质既可以做防腐剂,又可以做调味剂的是( )
| A. | 食盐 | B. | 纯碱 | C. | 甘氨酸 | D. | 味精 |
2.在恒温、恒容下,当反应容器内总压强不随时间变化时,下列可逆反应一定达到平衡的( )
| A. | 3M(气)+2N(气)?P(气)+4Q(气) | B. | M(气)+2N(气)?3P(气)+Q(固) | ||
| C. | M(气)+N(气)?P(气) | D. | 以上都达到平衡 |
12.下列有关化学用语表达不正确的是( )
| A. | CO2分子的结构式:O=C=O | |
| B. | 氯气分子的电子式 Cl:Cl | |
| C. | Cl-的离子结构示意图: | |
| D. | 原子核内有10个中子的氧原子${\;}_{8}^{16}O$ |
18.下列各组有机化合物中,不论两者以什么比例混合,只要总物质的量一定,完全燃烧时生成水的质量和消耗氧气的质量就不变的是( )
| A. | C3H6,C4H8 | B. | C3H6,C4H6O | C. | C2H6,C3H6O2 | D. | CH4O,C3H4O2 |
 3,4-二甲基-6-乙基辛烷
3,4-二甲基-6-乙基辛烷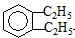 邻二乙基苯或1,2-二乙基苯
邻二乙基苯或1,2-二乙基苯