题目内容
15.下列说法中正确的是( )| A. | 可以用KSCN溶液检验${\;}_{26}^{45}$FeCl3和${\;}_{26}^{56}$FeCl3 | |
| B. | H2O与D2O互称同素异形体 | |
| C. | 副族元素中没有非金属元素,所以又称过渡金属 | |
| D. | F-与K两种微粒之间可以形成离子键 |
分析 A.${\;}_{26}^{45}$FeCl3和${\;}_{26}^{56}$FeCl3溶液中都含有铁离子,都能够与硫氰化钾反应显示红色;
B.同素异形体的研究对象为单质;
C.副族元素都是金属元素,又称为过渡金属;
D.氟离子为阴离子,K原子为中性原子,二者不能形成离子键.
解答 解:A.中子数不影响铁离子的化学性质,所以KSCN溶液能够与${\;}_{26}^{45}$FeCl3和${\;}_{26}^{56}$FeCl3反应显示红色,不能用硫氰化钾检验两溶液,故A错误;
B.H2O与D2O都是水,而同素异形体为同种元素形成的不同单质,所以二者不属于同素异形体,故B错误;
C.副族元素属于过渡元素,过渡元素都是金属元素,所以副族元素都是金属元素,故C正确;
D.F-为带有1个负电荷的阴离子,而K原子为中性原子,二者不会形成离子键,故D错误;
故选C.
点评 本题考查了常见离子键的判断、元素周期表结构及其应用、同素异形体的判断等知识,题目难度中等,明确离子键的形成条件、同素异形体的概念及为解答关键,注意掌握原子结构与元素周期表关系.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
3.在天平两端的两个烧杯中放有相同体积和相同物质的量浓度的盐酸,调节天平保持平衡.分别加入一定量的镁和铝,两种金属完全反应后,天平仍保持平衡,则加入镁和铝的物质的量之比为( )
| A. | 9:8 | B. | 11:12 | C. | 12:11 | D. | 3:4 |
10.下列有关实验的装置、试剂选用或操作正确的是( )
| A.配制0.10mol•L-1溶液 | B.除去CO中的CO2 | C.苯萃取碘水中I2,分出水层后的操作 | D.记录滴定终点读数为12.20mL |
 | 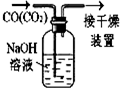 |  |  |
| A. | A | B. | B | C. | C | D. | D |
20.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 标准状况下,22.4LNO与CO2的混合气体中含有O原子数为3NA | |
| B. | 0.1mol NH3溶于足量水中(不考虑氨气挥发),溶液中N原子的数目为0.1NA | |
| C. | 0.1molN2与足量的H2反应,转移的电子数是0.6NA | |
| D. | 58.5 g的NaCl固体中含有NA个氯化钠分子 |
7.下列各组离子在指定溶液中,一定能大量共存的是( )
| A. | 加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,SO42- | |
| B. | 含有NaClO的溶液中:K+,Al3+,Br-,S2- | |
| C. | 澄清透明溶液:Cu2+、SO42-、HCO3-、H+ | |
| D. | 使甲基橙变红的溶液中:Fe2+,MnO4-,Na+,SO42- |
4.下列表示对应化学反应的离子方程式正确的是( )
| A. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | 向FeBr2溶液中通入足量 Cl2:2Fe2++2Br-+2Cl2═Br2+2Fe3++4Cl- | |
| D. | 向50 mL 1 mol•L-1明矾溶液中滴入两滴0.1 mol•L-1Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
 某温度时,在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析: