题目内容
6.为了探究过氧化钠的强氧化性,某研究性学习小组设计了如图所示的实验装置.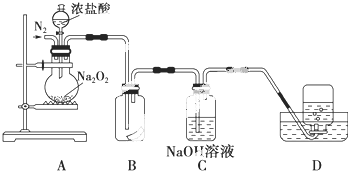
实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器.
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓
盐酸,剧烈反应,有气体产生.
③一段时间后,将导管末端伸入集气瓶中收集气体.装置D中收集到能使带火星的木条复燃的无色气体.
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色.
回答下列问题:
(1)装置B中湿润的红色纸条褪色,证明A中反应有Cl2(填化学式)生成.若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因4H++4I-+O2═2I2+2H2O(或4I-+O2+2H2O═2I2+4OH-).
(2)装置C的作用是吸收HCl和过量的Cl2,防止污染空气,使D中能收集到较为纯净的氧气
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得.乙同学认为此结论不正确,他可能的理由为①Na2O2被还原时氧元素的化合价应该降低,不可能得到O2;②O2有可能是Na2O2与盐酸中的H2O反应生成的
(4)实验证明,Na2O2与干燥的HCl能反应,完成并配平该化学方程式.
1Na2O2+4HCl═1 Cl2+2NaCl+2H2O
该反应不能(填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是实验室没有可直接使用的干燥HCl气体的物质、固体与气体反应较慢、产生的氯气中含有大量的氯化氢气体(答出任何一点即可,其他合理答案均可(要求答出两点).
分析 (1)HClO有漂白性,氯气和水反应生成HClO;O2、Cl2都具有强氧化性,都能将碘离子氧化为I2,I2遇淀粉试液变蓝色;
(2)Cl2有毒不能直接排空,如果O2中混有Cl2,会导致收集的O2不纯净;
(3)如果Na2O2被还原,则O元素应该得电子化合价降低;Na2O2还能和水反应生成氧气;
(4)根据元素守恒知,生成物中还有水生成,该反应中O元素化合价由-1价变为-2价、Cl元素化合价由-1价变为0价,根据转移电子相等配平方程式;
气体和固体反应较缓慢,且制得的氯气中含有大量HCl.
解答 解:(1)湿润的红色石蕊试纸褪色,说明有HClO生成,氯气和水反应生成HClO,所以说明装置A中有Cl2生成;若B中改放湿润的淀粉KI试纸,碘离子具有还原性,O2、Cl2都具有强氧化性,都能将碘离子氧化为I2,I2遇淀粉试液变蓝色,发生的离子反应方程式为4H++4I-+O2═2I2+2H2O(或4I-+O2+2H2O═2I2+4OH-),所以不能据此证明上述结论,
故答案为:Cl2;4H++4I-+O2═2I2+2H2O(或4I-+O2+2H2O═2I2+4OH-);
(2)Cl2有毒不能直接排空,如果O2中混有Cl2,会导致收集的O2不纯净,且盐酸具有挥发性,导致生成的气体中含有HCl,氯气、HCl都能和NaOH反应而除去,则NaOH的作用是吸收HCl和过量的Cl2,防止污染空气,使D中能收集到较为纯净的氧气,
故答案为:吸收HCl和过量的Cl2,防止污染空气,使D中能收集到较为纯净的氧气;
(3)①如果Na2O2被还原,则O元素应该得电子化合价降低,不能是化合价升高,
Na2O2被还原时氧元素的化合价应该降低,不可能得到O2
②水和过氧化钠反应也生成氧气,O2有可能是Na2O2与盐酸中的H2O反应生成的;
故答案为:Na2O2被还原时氧元素的化合价应该降低,不可能得到O2;O2有可能是Na2O2与盐酸中的H2O反应生成的;
(4)根据元素守恒知,生成物中还有水生成,该反应中O元素化合价由-1价变为-2价、Cl元素化合价由-1价变为0价,根据转移电子相等配平方程式为Na2O2+4HCl═Cl2+2NaCl+2H2O,
实验室没有可直接使用的干燥HCl气体的物质、固体与气体反应较慢、产生的氯气中含有大量的氯化氢气体,所以该实验不能用于实验室快速制取纯净的Cl2,
故答案为:1;4;1;2;2H2O;不能;实验室没有可直接使用的干燥HCl气体的物质、固体与气体反应较慢、产生的氯气中含有大量的氯化氢气体(答出任何一点即可,其他合理答案均可).
点评 本题考查性质实验探究,侧重考查学生动手操作、分析问题能力,物质的性质是实验设计的依据,性质、制备实验方案设计是高考高频点,综合性较强,涉及知识点较多,熟练掌握元素化合物知识,题目难度中等.

| A. |  干燥SO2气体 | |
| B. |  蒸发CH3COONa溶液得醋酸钠晶体 | |
| C. |  分离有机层与水层,水层从分液漏斗下口放出 | |
| D. |  测量氯气的体积 |
| A. | 常温常压下22.4L的CO2在一定条件下与足量的镁反应,转移4NA个电子 | |
| B. | 60g SiO2中含硅氧键数目为4NA | |
| C. | 1.00mol NaCl中含有6.02×1023个NaCl分子 | |
| D. | 3.9gNa2O2中所含的阴离子数目为0.1NA |
| A. | 常温常压下,11.2 L甲烷中含有的氢原子数为2NA | |
| B. | 标准状况下,0.3 mol二氧化硫中含有的氧原子数为0.3NA | |
| C. | 常温常压下,2 g H2的分子数为NA | |
| D. | 常温常压下,1 mol/L MgCl2溶液中含Cl-数为2NA |
| A. | 可以用KSCN溶液检验${\;}_{26}^{45}$FeCl3和${\;}_{26}^{56}$FeCl3 | |
| B. | H2O与D2O互称同素异形体 | |
| C. | 副族元素中没有非金属元素,所以又称过渡金属 | |
| D. | F-与K两种微粒之间可以形成离子键 |
| A. | 热稳定性:Na2CO3>NaHCO3>H2CO3 | B. | 溶解度:Na2CO3<NaHCO3 | ||
| C. | 熔点:Rb>K>Na>Li | D. | 还原性:Rb<K<Na<Li |
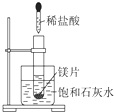 如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入一小块镁片,再用滴管滴入10mL 0.2mol/L的稀盐酸于试管中,测得生成氢气在标况的体积为11.2mL后反应停止,同时观察到盛饱和石灰水的烧杯中出现浑浊的现象.请回答下列问题:
如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入一小块镁片,再用滴管滴入10mL 0.2mol/L的稀盐酸于试管中,测得生成氢气在标况的体积为11.2mL后反应停止,同时观察到盛饱和石灰水的烧杯中出现浑浊的现象.请回答下列问题: