题目内容
【题目】某校化学研究性学习小组设计如下实验方案,测定NaHCO3和Na2CO3混合物中NaHCO3的质量分数。
方案一:按下图装置进行实验。并回答以下问题。
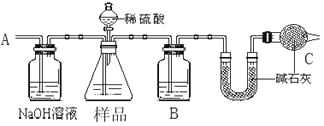
①按图组装仪器并检查装置的气密性。
②实验前称取17.90g样品,从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止, 从导管A处缓缓鼓入一定量的空气。
③实验结束后测得U型管增重 8.80g。
(1)B瓶中装的试剂为______,C装置的作用是__________________________。
(2)从导管A处缓缓鼓入一定量的空气的目的是_______________。
(3)该样品中NaHCO3的质量分数为_____________。
方案二:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量Ba(OH)2溶液。过滤洗涤,干燥沉淀,称量固体质量,进行有关计算。
请回答:实验中判断沉淀是否完全的方法是_____________________________________。
【答案】浓H2SO4 防止空气中水蒸气、CO2进入U型管被吸收 把反应产生的CO2全部导入U形管中 70.4% 取少量滤液,再滴加少许Ba(OH)2溶液,如无白色沉淀说明沉淀完全
【解析】
方案一:测定NaHCO3和Na2CO3混合物中NaHCO3的质量分数,由实验装置可知,从导管A处缓缓鼓入一定量的空气,先将装置中的二氧化碳排出,NaOH溶液可除去空气中的二氧化碳,锥形瓶中发生样品与硫酸的反应生成二氧化碳气体,B中应为浓硫酸干燥二氧化碳,U型管增重为反应生成二氧化碳的质量,干燥管中的碱石灰防止空气中的二氧化碳进入U型管中干扰含量的测定;
方案二:小烧杯中加入足量Ba(OH)2溶液,NaHCO3和Na2CO3均反应,生成沉淀为碳酸钡,向滤液中继续滴氢氧化钡观察是否生成沉淀判断是否沉淀完全。
方案一:测定NaHCO3和Na2CO3混合物中NaHCO3的质量分数,由实验装置可知,从导管A处缓缓鼓入一定量的空气,先将装置中的二氧化碳排出,NaOH溶液可除去空气中的二氧化碳,锥形瓶中发生样品与硫酸的反应生成二氧化碳气体,B中应为浓硫酸干燥二氧化碳,U型管增重为反应生成二氧化碳的质量,干燥管中的碱石灰防止空气中的二氧化碳进入U型管中干扰含量的测定,
(1)由上述分析可知B瓶中装的试剂为浓硫酸,C装置的作用是防止空气中水蒸气、CO2进入U型管被吸收,故答案为浓硫酸;防止空气中水蒸气、CO2进入U型管被吸收;
(2)导管A处缓缓鼓入一定量的空气的目的是把反应产生的CO2全部导入U形管中,故答案为把反应产生的CO2全部导入U形管中;
(3)设NaHCO3和Na2CO3的质量分别为x、y,则x+y=17.90,![]() +
+![]() =
=![]() ,两式联立解得x=12.6g,该样品中NaHCO3的质量分数为
,两式联立解得x=12.6g,该样品中NaHCO3的质量分数为![]() ×100%=70.4%,故答案为70.4%;
×100%=70.4%,故答案为70.4%;
方案二:小烧杯中加入足量Ba(OH)2溶液,NaHCO3和Na2CO3均反应,生成沉淀为碳酸钡,判断沉淀是否完全的方法是取少量滤液,再滴加少许Ba(OH)2溶液,如无白色沉淀说明沉淀完全,故答案为取少量滤液,再滴加少许Ba(OH)2溶液,如无白色沉淀说明沉淀完全。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】利用图示实验装置可完成多种实验,其中不能达到相应实验目的的是

选项 | 试剂1、试剂2 | 实验目的 |
A | 过量锌粒、食醋溶液 | 测定食醋中醋酸浓度 |
B | 粗锌、过量稀硫酸 | 测定粗锌(含有不参与反应的杂质)纯度 |
C | 碳酸钠固体、水 | 证明碳酸钠水解吸热 |
D | 过氧化钠固体、水 | 证明过氧化钠与水反应产生气体 |
A.AB.BC.CD.D


