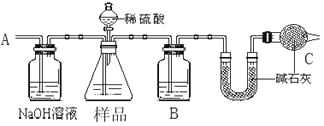
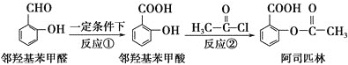
题目内容
【题目】硼及硼的化合物有着广泛的用途。请回答下列问题:
(1)硼酸(H3BO3)在水中电离出阴离子B(OH)4-,请试着写出硼酸的电离方程式___________。
(2)已知:H3BO3的电离常数Ka=5.8×1010,H2S的电离常数掏Ka1=5.7×108、Ka2=1.2×1015,向饱和硼酸溶液中滴加0.1 mol·L1 Na2S溶液,写出发生反应的离子方程式_________。
(3)BCl3主要用作半导体硅的掺杂源,遇水强烈水解,0.01mol BCl3溶于300mL蒸馏水中(溶液体积变化忽略不计),则所得溶液的pH值约为___________。
【答案】H3BO3+H2O![]() H++ B(OH)4- S2-+H3BO3= HS-+H2BO3-或S2-+H3BO3=HS-+BO2-+H2O 1
H++ B(OH)4- S2-+H3BO3= HS-+H2BO3-或S2-+H3BO3=HS-+BO2-+H2O 1
【解析】
(1)根据电离方程式的书写规则及电荷守恒、原子守恒分析解答;(2)根据电离平衡常数与酸性强弱的关系分析解答;(3)根据水解方程式及pH表达式进行相关计算。
(1)硼酸(H3BO3)在水中电离出阴离子B(OH)4-,则根据原子守恒及电荷守恒分析知,硼酸的电离方程式为H3BO3+H2O![]() H+ + B(OH)4-,故答案为:H3BO3+H2O
H+ + B(OH)4-,故答案为:H3BO3+H2O![]() H+ + B(OH)4-。
H+ + B(OH)4-。
(2)根据平衡常数的大小分析知酸性强弱顺序为:H2S>H3BO3>NaHS,则根据强酸制弱酸原理,向饱和硼酸溶液中滴加0.1 mol·L1 Na2S溶液,反应生成NaHS、NaH2BO3,离子方程式为S2-+H3BO3= HS-+H2BO3-,故答案为:S2-+H3BO3= HS-+H2BO3-或S2-+H3BO3=HS-+BO2-+H2O;
(3)根据BCl3水解方程式计算得:BCl3+3H2O=H3BO3+3HCl,c(H+)=![]() ,所以Ph=-lg c(H+)=1,故答案为:1。
,所以Ph=-lg c(H+)=1,故答案为:1。

【题目】(1)已知:①CO燃烧热为283.0kJ·mol-l,②N2(g)+O2(g) =2NO(g) △H=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应,能消除污染,写出该反应的热化学方程式______________。
(2)某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应:
)在刚性容器内发生反应:![]() (g)+ I2(g)
(g)+ I2(g)![]()
![]() (g)+2HI(g) ΔH=+89.3 kJ·mol 1,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为____,该反应的平衡常数Kp=____Pa(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有____(填标号)。
(g)+2HI(g) ΔH=+89.3 kJ·mol 1,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为____,该反应的平衡常数Kp=____Pa(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有____(填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
(3)室温下,烟气中的SO2可用某浓度的NaOH溶液吸收得到pH=7的溶液,试计算所得溶液中![]() =_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
=_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
(4)烟气中的SO2也可用Na2SO3溶液吸收,吸收过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 99:1 | 1:1 | 1:99 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度由小到大的顺序为___________。