题目内容
【题目】能源、环境与生产生活和社会发展密切相关.
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1 . 相关数据如表:
容器 | 甲 | 乙 |
反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH (g)和 |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出29.4kJ | 吸收a kJ |
①下列情况能说明该反应一定达到平衡状态的是(填字母).
a.v(CO2)消耗=v(CH3OH)生成
b.气体的密度不再随时间改变
c.CO2和CH3OH的浓度之比不再随时间改变
d.气体的平均相对分子质量不再随时间改变
②其他条件不变,达到平衡后,下列不能提高H2转化率的操作是(填字母).
a.降低温度b.充入更多的H2c.移除甲醇d.增大容器体积
③c1c2(填“>”“<”或“=”),a= .
④该温度下反应的平衡常数K=;若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)= .
(2)已知反应:2NO2(红棕色)N2O4(无色)△H<0.将一定量的NO2充入注射器后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是(填字母). 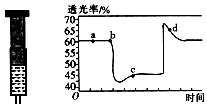
A.b点的操作是拉伸注射器
B.d点:v正<v逆
C.c点与a点相比,c(NO2)增大,c(N2O4)减小
D.若不忽略体系温度变化,且没有能量损失,则Tb>Tc .
【答案】
(1)cd; bd;=;19.6; ![]() (或2.1);0.09mol?L﹣1?s﹣1
(或2.1);0.09mol?L﹣1?s﹣1
(2)B
【解析】解:(1)①CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1,
a.反应速率之比等于化学方程式计量数之比为正反应速率之比,v(CO2)消耗=v(CH3OH)生成只能说明反应正向进行,不能说明反应达到平衡状态,故a错误;
b.反应前后气体质量不变,体积不变,气体密度始终不变,气体的密度不再随时间改变,故b错误;
c.CO2和CH3OH的浓度之比不再随时间改变,说明正逆反应速率相同,故c正确;
d.气体质量不变,气体物质的量减小,气体的平均相对分子质量不再随时间改变,说明反应达到平衡状态,故d正确;
所以答案是:cd;
②a.反应为放热反应,降低温度,平衡正向进行,氢气转化率增大,故a不符合;
b.充入更多的H2 会提高二氧化碳的转化率,氢气转化率减小,故b符合;
c.移除甲醇平衡正向进行,氢气转化率增大,故c不符合;
d.增大容器体积,压强减小,平衡逆向进行,氢气转化率减小,故d符合;
所以答案是:bd;
③应用恒温恒容条件下的乙的投料量极端转化为甲相当于投1mol CO2(g)和3mol H2(g),所以两者是等效平衡,所以c1=c2,甲、乙是等效平衡,则甲中放出的热量与乙中吸收的热量之和为49.0kJ,则a=49.0kJ﹣29.4kJ=19.6kJ,
所以答案是:=;19.6;
④
CO2(g)+ | 3H2(g) | CH3OH(g)+ | H2O(g) | △H=﹣49.0kJmol﹣1 | |
起始(mol/L) | 1 | 3 | 0 | 0 | 49 kJ |
转化(mol/L) | 0.6 | 1.8 | 0.6 | 0.6 | 29.4 kJ |
平衡(mol/L) | 0.4 | 1.2 | 0.6 | 0.6 |
平衡浓度c(CO2)=0.2mol/L,c(H2)=0.6mol/L,c(CH3OH)=0.3mol/L,c(H2O)=0.3mol/L
K= ![]() =
= ![]() ≈2.1,
≈2.1,
甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)= ![]() =0.09 molL﹣1s﹣1,
=0.09 molL﹣1s﹣1,
所以答案是: ![]() (或2.1);0.09 molL﹣1s﹣1;(2)A、b点开始是压缩注射器的过程,气体颜色变深,透光率变小,故A错误;
(或2.1);0.09 molL﹣1s﹣1;(2)A、b点开始是压缩注射器的过程,气体颜色变深,透光率变小,故A错误;
B、c点后的拐点是拉伸注射器的过程,d点是平衡向气体体积增大的逆向移动过程,所以v(逆)>v(正),故B正确;
C、c点是压缩注射器后的情况,二氧化氮和四氧化二氮的浓度都增大,故C错误;
D、b点开始是压缩注射器的过程,平衡正向移动,反应放热,导致T(b)<T(c),故D错误;
所以答案是:B.

 名校课堂系列答案
名校课堂系列答案