��Ŀ����
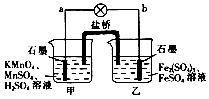
����Ŀ���絼�ʿ����ں����������Һ���������Ĵ�С���ҵ絼��Խ����Һ�ĵ�������Խǿ�������� ����0.l00 mol��L-1��NH3�� H2O �ζ�10 .00mL Ũ�Ⱦ�Ϊ0 . 100 mol��L-1HCl��CH3COOH�Ļ��Һ���絼��������ͼ��ʾ������˵����ȷ����
A���� ��Һ��c��H +��Ϊ0 . 200 mol��L-1
B����Һ�¶ȸߵ�Ϊ�� ���� ����
C���� �����������Ŀ����ʹ�絼���Խ���
D���� ��ʱ��Һ����c ( C1һ������CH3 COOһ��
���𰸡�D
��������
�����������Ũ�Ⱦ�Ϊ0 . 100 mol��L-1HCl��CH3COOH�Ļ��Һ�еμ�NH3�� H2O�����ȷ�����Ӧ��HCl+NH3�� H2O=NH4Cl+H2O��������Һ�������ƶ������ӵ����ʵ������䣬����Ϊ��Һ����������������ӵ�Ũ�ȼ�С���絼����С�����÷�Ӧǡ�÷���ʱ���絼����С���˺�����Ӧ��CH3COOH+ NH3�� H2O=CH3COONH4+H2O��������ʱ�Ϊǿ����ʣ������ƶ�������Ũ�������絼����������Ӧǡ����ȫʱ����Һ���絼����˺��ټ��백ˮ���Ͷ���Һ��ϡ�����ã����ӵ�Ũ�ȼ�С���絼����С�����ݵ絼�ʵı仯��֪HCl��CH3COOH�ǰ���1:1����Ļ��Һ��A���� ��Һ������������ǿ�ᣬ���������ᣬ����c��H +��ԼΪ0 . 05 mol/L,����B�������絼�������������²ⶨ�ģ�������Һ�¶ȸߵ���ȣ�����C���� ���������Ũ������ʹ�絼���Խ�������D���� ��ʱ��ҺΪNH4Cl��CH3COONH4�ȵ�Ũ�ȡ�������Ļ����Һ������笠�����ˮ�����ģ�������Һ����c ( C1һ������CH3 COOһ������ȷ��

 �����Ļ�������ҵϵ�д�
�����Ļ�������ҵϵ�д�����Ŀ��Ԫ�����ڱ���ѧϰ��ѧ����Ҫ���ߣ���������������Ϣ���ɣ��±����������ֶ����ڵ�ԭ�Ӱ뾶����Ҫ���ϼۣ���֪���ԭ�Ӱ뾶Ϊ0.089nm����
Ԫ�ش��� | A | B | C | D | E | F | G |
ԭ�Ӱ뾶/nm | 0.037 | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
��Ҫ���ϼ� | +1 | +2 | +3 | +6��-2 | -1 | -2 | +5��-3 |
(1)CԪ����Ԫ�����ڱ��е�λ���� ______ ��
(2)B��ԭ�ӽṹʾ��ͼΪ ______ ��
(3)D��E��̬�⻯����ȶ���ǿ��˳��Ϊ ______ ���ѧʽ����
(4)��������Ԫ�ص�����������Ӧˮ������������ǿ���� ______ ���ѧʽ����
(5)��CΪ�����Ƴɵ�������������ǿ����Һ�������ӷ���ʽ��ʾ��ԭ��Ϊ�� ______ ��
(6)�ڣ�52Te����ij�������dz��õ�VCR���̼�¼����֮һ�����ڼ��������·�����ѧ�����������ܸı����¼�������źţ��Ʋ���Ԫ�������ڱ��е�λ�ã�����Ԫ�ؼ��仯������ܾ��е�����Ϊ��______ ��
A���������ڳ������ǹ���B��Cl2ͨ��H2Te��Һ�в�������Ӧ
C��H2Te����HI�ȶ� D��H2TeO4�����Ա�H2SO4����
����Ŀ����Դ�������������������ᷢչ������أ�
��1��һ���¶��£��������ݻ���Ϊ2L���ܱ������У��ֱ�����Ӧ��CO2��g��+3H2��g��CH3OH��g��+H2O��g����H=��49.0kJmol��1 �� ������������
���� | �� | �� |
��Ӧ��Ͷ���� | 1mol CO2��g����3mol H2��g�� | 1mol CH3OH ��g���� |
ƽ��ʱc��CH3OH�� | c1 | c2 |
ƽ��ʱ�����仯 | �ų�29.4kJ | ����a kJ |
�����������˵���÷�Ӧһ���ﵽƽ��״̬����������ĸ����
a��v��CO2������=v��CH3OH������
b��������ܶȲ�����ʱ��ı�
c��CO2��CH3OH��Ũ��֮�Ȳ�����ʱ��ı�
d�������ƽ����Է�������������ʱ��ı�
�������������䣬�ﵽƽ������в������H2ת���ʵIJ�����������ĸ����
a�������¶�b����������H2c���Ƴ��״�d�������������
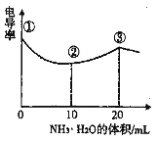
��c1c2���������������=������a= ��
�ܸ��¶��·�Ӧ��ƽ�ⳣ��K=�������з�Ӧ10sʱ�ﵽƽ�⣬��0��10s�ڼ��е�ƽ����Ӧ����v��H2��= ��
��2����֪��Ӧ��2NO2������ɫ��N2O4����ɫ����H��0����һ������NO2����ע�������ڣ���ͼ���������ѹ��ע�����Ĺ���������������ʱ��ı仯��������ɫԽ�����ԽС��������˵����ȷ����������ĸ���� 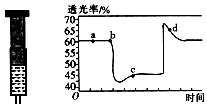
A.b��IJ���������ע����
B.d�㣺v����v��
C.c����a����ȣ�c��NO2������c��N2O4����С
D.����������ϵ�¶ȱ仯����û��������ʧ����Tb��Tc ��