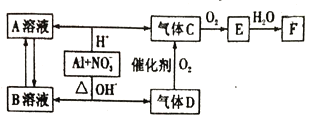
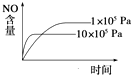题目内容
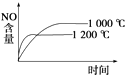
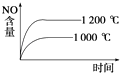
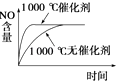
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述中正确的是( )
4NO(g)+6H2O(g),下列叙述中正确的是( )
A. 达到化学平衡时,5v正(O2)=4v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 未达到化学平衡时,正反应速率一定不等于逆反应速率
D. 达到化学平衡时,3v正(NH3)=2v正(H2O)不成立
【答案】C
【解析】A,达到化学平衡时正逆反应速率相等,各物质反应速率之比等于其化学计量数之比,因此4v正(O2)=5v逆(NO),故A错误;B.单位时间内消耗x mol NH3与生成x mol NO都表示正反应速率,整个反应过程中二者都相等,不能说明反应达到平衡状态,故B项错误;C.达到化学平衡的标志是正逆反应速率相等,各物质的浓度不再改变。所以未达到化学平衡时,正反应速率一定不等于逆反应速率,故C正确;D.达到化学平衡时正逆反应速率相等,各物质反应速率之比等于其化学计量数之比,因此3v正(NH3)=2v正(H2O)成立,故D错误;答案C。

【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm).
元素代号 | A | B | C | D | E | F | G |
原子半径/nm | 0.037 | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
主要化合价 | +1 | +2 | +3 | +6、-2 | -1 | -2 | +5、-3 |
(1)C元素在元素周期表中的位置是 ______ ;
(2)B的原子结构示意图为 ______ ;
(3)D、E气态氢化物的稳定性强弱顺序为 ______ (填化学式);
(4)上述七种元素的最高价氧化物对应水化物中酸性最强的是 ______ (填化学式);
(5)以C为材料制成的容器不能贮存强碱溶液,用离子方程式表示其原因为: ______ ;
(6)碲(52Te)的某化合物是常用的VCR光盘记录材料之一,可在激光照射下发生化学或物理的性能改变而记录、储存信号.推测碲元素在周期表中的位置,则碲元素及其化合物可能具有的性质为:______ ;
A.单质碲在常温下是固体B.Cl2通入H2Te溶液中不发生反应
C.H2Te不如HI稳定 D.H2TeO4的酸性比H2SO4的弱
【题目】能源、环境与生产生活和社会发展密切相关.
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1 . 相关数据如表:
容器 | 甲 | 乙 |
反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH (g)和 |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出29.4kJ | 吸收a kJ |
①下列情况能说明该反应一定达到平衡状态的是(填字母).
a.v(CO2)消耗=v(CH3OH)生成
b.气体的密度不再随时间改变
c.CO2和CH3OH的浓度之比不再随时间改变
d.气体的平均相对分子质量不再随时间改变
②其他条件不变,达到平衡后,下列不能提高H2转化率的操作是(填字母).
a.降低温度b.充入更多的H2c.移除甲醇d.增大容器体积
③c1c2(填“>”“<”或“=”),a= .
④该温度下反应的平衡常数K=;若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)= .
(2)已知反应:2NO2(红棕色)N2O4(无色)△H<0.将一定量的NO2充入注射器后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是(填字母). 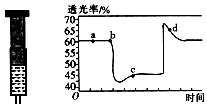
A.b点的操作是拉伸注射器
B.d点:v正<v逆
C.c点与a点相比,c(NO2)增大,c(N2O4)减小
D.若不忽略体系温度变化,且没有能量损失,则Tb>Tc .