题目内容
【题目】下列说法或表示法正确的是( )
A.CO(g)的燃烧热是283.0kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为:2CO(g)+O2(g)=2CO2(g) △H=-283.0kJ·mol-1
B.当反应物的总能量比生成物的总能量高时,为吸热反应;当生成物的总能量比反应物的总能量高时,则为放热反应
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含lmolNaOH的溶液混合,放出的热量等于57.3kJ
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
【答案】D
【解析】
A. 燃烧热是1mol可燃物完全燃烧放出的能量,CO(g)的燃烧热是283.0kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为: CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ·mol-1,故A错误;
O2(g)=CO2(g) △H=-283.0kJ·mol-1,故A错误;
B. 当反应物的总能量比生成物的总能量高时,为放热反应;当生成物的总能量比反应物的总能量高时,则为吸热反应,故B错误;
C. 在稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1,浓硫酸稀释放热,所以将含0.5molH2SO4的浓硫酸与含lmolNaOH的溶液混合,放出的热量大于57.3kJ,故C错误;
D. 2gH2的物质的量是1mol,完全燃烧生成液态水,放出285.8kJ热量,表示氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1,故D正确;

【题目】某冶炼厂利用含ZnO的烟灰脱除工业废气中的SO2,最终得到锌盐。该厂所用烟灰的主要成分如下表所示:
主要成分 | ZnO | CaO | Fe2O3 | SiO2 | 其它 |
质量分数/% | 81 | 0.098 | 1.14 | 0.5 | ———— |
在一定条件下,将含SO2的工业废气通入烟灰浆液(烟灰和水的混合物)进行脱硫,过程中测得pH和上清液中溶解的SO2物质的量浓度[c(SO2)]随时间的变化如图所示:

(1)纯ZnO浆液的pH为6.8,但上述烟灰浆液的初始pH为7.2。在开始脱硫后3 min内(a~b段),pH迅速降至6.8,引起pH迅速变化的原因是_____(结合化学用语解释)。
(2)生产中脱除SO2效果最佳的时间范围是_____(填字母序号)。
A.20~30 min B.30~40 min C.50~60 min D.70~80 min
(3)在脱硫过程中涉及到的主要反应原理:
Ⅰ.ZnO + SO2 === ZnSO3↓
Ⅱ.ZnSO3 + SO2 + H2O === Zn(HSO3)2
①在30~40 min时,主要发生反应II,生成可溶性的Zn(HSO3)2。上清液中c(SO2)上升的原因可能是______。
②在30~80 min时,pH降低的原因可能是______(写出2点)。
③将脱硫后的混合物利用空气氧化技术处理,该过程中发生反应:2ZnSO3 + O2 === 2ZnSO4和______。
【题目】化学平衡移动原理在生产、生活、科研中有重要应用。
(1)生活中明矾[KAl(SO4)2·12H2O]常用作净水剂,其净水的原理是_____(用离子方程式表示)。
(2)工业上在850℃时用钠还原熔融态氯化钾的方法制备金属钾,发生的反应方程式为:Na(l) + KCl(l)![]() NaCl(l) + K(g),能制备钾的原因是_______。
NaCl(l) + K(g),能制备钾的原因是_______。
(3)测得某工厂废水中含Cr2O72–的浓度为3.0×10–4 mol·L1,常温下,对该有害离子的处理流程如下:{已知:绿矾的化学式为FeSO4·7 H2O, Ksp [Cr(OH)3]=6.0×10–31 }
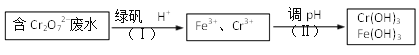
① 步骤(Ⅰ)中发生反应的离子方程式为_________。
② 若忽略加入各种试剂后的废水体积变化,则Cr3+开始沉淀的pH为_________。
(4)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。查阅资料:25℃时,Ksp (AgCl)=1.8×10–10,Ksp (AgI)=8.3×10–17。
操作步骤 | 现象 |
步骤1:向2 mL 0.1 mol·L1AgNO3溶液中加入2 mL 0.1 mol·L1 NaCl溶液,得到浊液a,过滤。 | 得滤液b和白色沉淀c |
步骤2:向滤液b中滴加0.1 mol·L1 KI溶液。 | 出现浑浊 |
步骤3:向白色沉淀c中滴加0.1 mol·L1 KI溶液。 | 白色沉淀变为黄色 |
① 浊液a中存在沉淀溶解平衡(用方程式表示)______________。
② 用化学平衡原理解释步骤3中的实验现象_________。