题目内容
【题目】在不同温度下,向V L密闭容器中加入0.5mol NO和0.5mol活性炭,发生反应:2NO(g)+C(s) ![]() N2(g)+CO2(g) ΔH=-Q kJ·mol-1(Q>0),达到平衡时的数据如下表:
N2(g)+CO2(g) ΔH=-Q kJ·mol-1(Q>0),达到平衡时的数据如下表:
温度/℃ | n(C)/mol | n(CO2)/mol |
T1 | 0.15 | |
T2 | 0.375 |
下列有关说法正确的是( )
A.由上述信息可推知:T1>T2
B.T2℃条件下,若反应达到平衡后再缩小容器的体积,c(N2):c(NO)增大
C.T1℃条件下,若开始时反应物的用量均减小一半, 平衡后NO的转化率增大
D.![]() ℃条件下,该反应的平衡常数
℃条件下,该反应的平衡常数![]()
【答案】D
【解析】
A. 温度T2时,活性炭的平衡物质的量为0.375mol,则消耗的n(活性炭)=0.5mol0.375mol=0.125mol,故消耗的n(NO)=0.25mol,平衡时n(NO)=0.5mol0.25mol=0.25mol,生成的n(N2)=0.125mol,生成的n(CO2)=0.125mol,温度T1时,生成的n(CO2)=0.15mol,反应2NO(g)+C(s) ![]() N2(g)+CO2(g)△H=213.5kJ/mol,正反应为放热反应,升温平衡逆向移动,所以T1<T2,故A错误;
N2(g)+CO2(g)△H=213.5kJ/mol,正反应为放热反应,升温平衡逆向移动,所以T1<T2,故A错误;
B. 反应2NO(g)+C(s) ![]() N2(g)+CO2(g)是一个气体体积不变的反应,平衡后再缩小容器的体积,压强增大,但平衡不移动,故c(N2):c(NO)不变,故B错误;
N2(g)+CO2(g)是一个气体体积不变的反应,平衡后再缩小容器的体积,压强增大,但平衡不移动,故c(N2):c(NO)不变,故B错误;
C. 反应2NO(g)+C(s) ![]() N2(g)+CO2(g)是一个气体体积不变的反应,开始时反应物的用量均减小一半,压强减小,但平衡不移动,平衡后NO的转化率不变,故C错误;
N2(g)+CO2(g)是一个气体体积不变的反应,开始时反应物的用量均减小一半,压强减小,但平衡不移动,平衡后NO的转化率不变,故C错误;
D. 2NO(g)+C(s) ![]() N2(g)+CO2(g)
N2(g)+CO2(g)
起始量(mol) 0.5 0.5 0 0
变化量(mol) 0.3 0.15 0.15 0.15
平衡量(mol) 0.2 0.35 0.150.15
温度T1,平衡时c(NO)=![]() =
= ![]() mol/L,c(N2)=
mol/L,c(N2)=![]() mol/L,c(CO2)=
mol/L,c(CO2)= ![]() mol/L,平衡常数K=
mol/L,平衡常数K=![]() =
=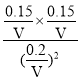 =
=![]() ,故D正确;
,故D正确;
故选:D。

【题目】某冶炼厂利用含ZnO的烟灰脱除工业废气中的SO2,最终得到锌盐。该厂所用烟灰的主要成分如下表所示:
主要成分 | ZnO | CaO | Fe2O3 | SiO2 | 其它 |
质量分数/% | 81 | 0.098 | 1.14 | 0.5 | ———— |
在一定条件下,将含SO2的工业废气通入烟灰浆液(烟灰和水的混合物)进行脱硫,过程中测得pH和上清液中溶解的SO2物质的量浓度[c(SO2)]随时间的变化如图所示:

(1)纯ZnO浆液的pH为6.8,但上述烟灰浆液的初始pH为7.2。在开始脱硫后3 min内(a~b段),pH迅速降至6.8,引起pH迅速变化的原因是_____(结合化学用语解释)。
(2)生产中脱除SO2效果最佳的时间范围是_____(填字母序号)。
A.20~30 min B.30~40 min C.50~60 min D.70~80 min
(3)在脱硫过程中涉及到的主要反应原理:
Ⅰ.ZnO + SO2 === ZnSO3↓
Ⅱ.ZnSO3 + SO2 + H2O === Zn(HSO3)2
①在30~40 min时,主要发生反应II,生成可溶性的Zn(HSO3)2。上清液中c(SO2)上升的原因可能是______。
②在30~80 min时,pH降低的原因可能是______(写出2点)。
③将脱硫后的混合物利用空气氧化技术处理,该过程中发生反应:2ZnSO3 + O2 === 2ZnSO4和______。