题目内容
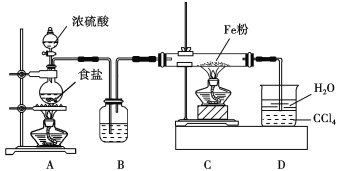
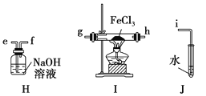
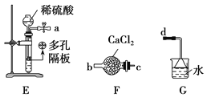
【题目】氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、医药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并有带刺激性气味的气体产生。实验室合成原理为SO2+ Cl2+ SCl2=2SOCl2装置如下图所示。请回答以下问题:
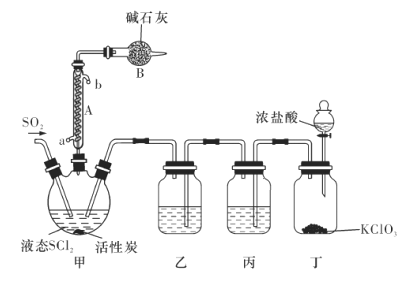
(1)仪器A的名称是________,装置乙中盛放的试剂是______装置B的作用是____________ 。
(2)装置丁中发生反应的离子方程式为___________________________。
(3)蒸干A1C13溶液不能得到无水A1C13,使SOCl2与A1C13·6H2O混合加热,可得到无水A1C13,试解释原因:_____________________________
(4)若反应中消耗的C12的体积为896 mL(已转化为标准状况下,SCl2、SO2足量),最后得到纯净的SOCl2 4.76 g,则SOCl2的产率为________(保留三位有效数字)。
(5)常温下,将0. 01 mol SOCl2加人100 mL 0. 3 mol/L NaOH溶液中恰好完全反应,所得溶液呈__________________(填“酸”“碱”或“中”)性,溶液中所有阴离子的浓度大小顺序为________________。(已知H2SO3的![]() =1 .52×10-2,
=1 .52×10-2,![]() =1.02×10-7)
=1.02×10-7)
(6)将少量SOCl2滴人5 mL 1 mol/L的AgNO3溶液中,有白色沉淀生成,该白色沉淀的成分是________________(填化学式)。
【答案】冷凝管(或蛇形冷凝管) 浓硫酸 吸收逸出的有毒的C12、S02,防止空气中的水蒸气进人反应装置导致SOCl2水解 C1O3-+5C1-+6H+ = 3C12↑+3H2O AlCl3易水解,A1C13·6H2O与SOCl2混合加热,SOCl2与A1C13·6H2O中的结晶水作用,生成无水A1C13及SO2和HC1气体,SOCl2吸水,产物SO2和HCl抑制A1C13水解 50.0% 酸 c(Cl-)>c(HS03-)>c(S032- )>c(OH-) AgCl、Ag2SO4
【解析】
(1)由图可以知道仪器,装置乙用来干燥氯气,装置B中的碱石灰与气体反应;
(2) 装置丁中利用KClO3、4HCl(浓)制备氯气,以此写出离子方程式;
(3) SOCl2与水反应的方程式为:SOCl2+H2O=SO2↑+2HCl↑,A1C13溶液易水解,A1C13·6H2O与SOCl2混合加热,SOCl2与A1C13·6H2O中的结晶水作用,生成无水A1C13及SO2和HCl气体,SOCl2吸水,产物SO2和HCl溶于水呈酸性抑制水解发生;
(4) 消耗氯气为![]() =0.04mol,由SO2+Cl2+SCl2=2SOCl2,生成0.08mol SOCl2,以此计算产率;
=0.04mol,由SO2+Cl2+SCl2=2SOCl2,生成0.08mol SOCl2,以此计算产率;
(5)0. 01 mol SOCl2与100 mL 0. 3 mol/L NaOH溶液中恰好完全反应,由原子守恒可知,反应方程式为SOCl2+3NaOH=NaHSO3+2NaCl+H2O,所得溶液溶质为亚硫酸氢钠和氯化钠,以此分析溶液酸碱性及离子浓度大小;
(6) SOCl2与H2O反应生成SO2和HCl,HCl与AgNO3溶液反应生成氯化银沉淀,溶液中有硝酸,将二氧化硫氧化为硫酸根离子,故白色沉淀中还有硫酸银,以此分析沉淀的成分。
(1)仪器c是(蛇形)冷凝管,装置乙用来干燥氯气,可盛放浓硫酸,装置B有两个作用一个是防止有毒的氯气与二氧化硫逸出对实验人员的身体健康造成威胁,一个是防止空气中的水蒸气进入烧瓶中使氯化亚砜水解,
因此,本题正确答案是:球冷凝管(或蛇形冷凝管) ;浓硫酸;吸收逸出的有毒的C12、SO2,防止空气中的水蒸气进人反应装置导致SOCl2水解;
(2) 装置丁中利用KClO3、4HCl(浓)制备氯气,反应的离子方程式为:C1O3-+5C1-+6H+ = 3C12↑+3H2O,
因此,本题正确答案是:C1O3-+5C1-+6H+ = 3C12↑+3H2O;
(3 SOCl2与水反应的方程式为:SOCl2+H2O=SO2↑+2HCl↑,A1C13溶液易水解,A1C13·6H2O与SOCl2混合加热,SOCl2与A1C13·6H2O中的结晶水作用,生成无水A1C13及SO2和HCl气体,SOCl2吸水,产物SO2和HCl溶于水呈酸性抑制水解发生,
因此,本题正确答案是:C1O3-+5C1-+6H+ = 3C12↑+3H2O ;AlCl3易水解,A1C13·6H2O与SOCl2混合加热,SOCl2与A1C13·6H2O中的结晶水作用,生成无水A1C13及SO2和HC1气体,SOCl2吸水,产物SO2和HCl抑制A1C13水解;
(4) 消耗氯气为![]() =0.04mol,由SO2+Cl2+SCl2=2 SOCl2,生成0.08mol SOCl2,则SOCl2的产率为
=0.04mol,由SO2+Cl2+SCl2=2 SOCl2,生成0.08mol SOCl2,则SOCl2的产率为![]() 100%=50.0%,
100%=50.0%,
因此,本题正确答案是:50.0%;
(5)0. 01 mol SOCl2与100 mL 0. 3 mol/L NaOH液中恰好完全反应,由原子守恒可知,反应方程式为SOCl2+3NaOH=NaHSO3+2NaCl+H2O,所得溶液溶质为亚硫酸氢钠和氯化钠,HSO3-在溶液中存在电离和水解,由于水解常数Kh=![]() =6.58
=6.58![]() 10-13<1.02
10-13<1.02![]() 10-7,即电离大于水解,故溶液呈酸性,溶液中所有阴离子的浓度大小顺序为c(Cl-)>c(HSO3-)>c(SO32- )>c(OH-),因此,本题正确答案是:(Cl-)>c(HSO3-)>c(SO32- )>c(OH-);
10-7,即电离大于水解,故溶液呈酸性,溶液中所有阴离子的浓度大小顺序为c(Cl-)>c(HSO3-)>c(SO32- )>c(OH-),因此,本题正确答案是:(Cl-)>c(HSO3-)>c(SO32- )>c(OH-);
(6) SOCl2+H2O=SO2↑+2HCl↑,氯化氢与AgNO3溶液反应生成氯化银沉淀,溶液中有硝酸,将二氧化硫氧化为硫酸根离子,故白色沉淀中还有硫酸银,所以该白色沉淀的成分是AgCl、Ag2SO4,
因此,本题正确答案是:AgCl、Ag2SO4。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和下图表示:
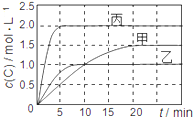
容器 | 甲 | 乙 | 丙 |
容积 | 1L | 1L | 2L |
温度 | T1 | T2 | T2 |
反应物 起始量 | 1molA 2molB | 1molA 2molB | 4molA 8molB |
下列说法正确的是 ( )
A. 由图可知:T1<T2,且该反应为吸热反应
B. T1时该反应的平衡常数K=7.2
C. 前10min甲、乙、丙三个容器中A的平均反应速率:v(A)乙<v(A)甲<v(A)丙
D. 平衡时A的质量m:m乙<m甲<m丙