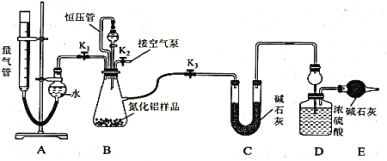
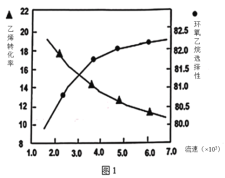
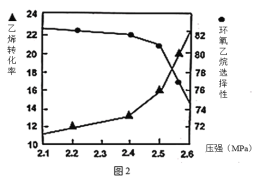
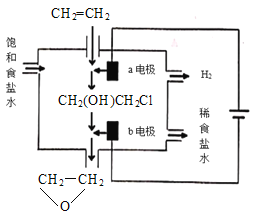
题目内容
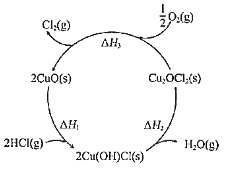
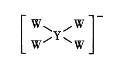
【题目】W、X、Y、Z均为短周期元素且原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,Y与W形成的阴离子(如图所示)中W不满足8电子稳定结构,W与Z的最高价之和为8。下列说法中错误的是
A.原子半径:Y>X>W
B.Z2O是某种弱酸的酸酐
C.W与X形成的二元化合物只能含极性键
D.最高价氧化物对应水化物的酸性:Z>X
【答案】C
【解析】
W、X、Y、Z它们的原子最外层电子数为互不相等的奇数,即最外层电子数分别为1、3、5、7,Y与W形成的阴离子 中W不满足8电子稳定结构,能形成一条共价键,则可知W为H元素,若Y的最外层电子数为5能形成3条共价键和一个配位键,但与H原子不能形成阴离子,若Y的最外层为3个电子,则Y得到一个电子后,可与氢原子形成4条共价键,构成阴离子,则Y的最外层为3个电子,W与Z的最高价之和为8,则Z的最外层为7个电子,X的最外层为5个电子,四种元素均为短周期元素且原子序数依次增大,则X为N元素,Y为Al元素,Z为Cl元素,据此分析解答。
中W不满足8电子稳定结构,能形成一条共价键,则可知W为H元素,若Y的最外层电子数为5能形成3条共价键和一个配位键,但与H原子不能形成阴离子,若Y的最外层为3个电子,则Y得到一个电子后,可与氢原子形成4条共价键,构成阴离子,则Y的最外层为3个电子,W与Z的最高价之和为8,则Z的最外层为7个电子,X的最外层为5个电子,四种元素均为短周期元素且原子序数依次增大,则X为N元素,Y为Al元素,Z为Cl元素,据此分析解答。
A.W为H元素,X为N元素,Y为Al元素,电子层数越多,半径越大,则原子半径:Y>X>W,故A正确;
B.Z为Cl元素,Z2O是Cl2O,Cl元素为+1价,与次氯酸中Cl元素的化合价相同,则Cl2O为次氯酸的酸酐,次氯酸为弱酸,故B正确;
C.W为H元素,X为N元素,W与X可形成多种二元化合物,其中形成的氨气中全部是N-H键为极性键,还可形成肼(N2H4),结构式为![]() ,既有极性共价键,又含有非极性共价键,故C错误;
,既有极性共价键,又含有非极性共价键,故C错误;
D.X为N元素, Z为Cl元素,非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性:N<Cl,即Z>X,则最高价氧化物对应水化物的酸性:Z>X,故D正确;
答案选C。

【题目】将NaOH和碳酸氢钠的固体混合物20.8 g在密闭容器中加热到约250 ℃,经充分反应后排出气体,冷却,称得剩余固体的质量为15.9 g。试计算原混合物中氢氧化钠的质量分数_________?
【题目】常温下,1mol化学键断裂形成气态原子所需要的能量用![]() 表示。结合表中信息判断下列说法不正确的是( )
表示。结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 432kJ/mol>E(H-Br)>298kJ/mol B. 表中最稳定的共价键是H-F键
C. H2(g)→2H(g) △H=+436kJ/mol D. H2(g)+F2(g)=2HF(g) △H=-25kJ/mol
【题目】已知常温下浓度为0.1mol/L的几种溶液的pH如右下表。下列有关说法正确的是( )
溶质 | pH |
NaF | 7.5 |
Na2CO3 | 11.6 |
NaClO | 9.7 |
NaHCO3 | 8.3 |
A. 同温度同浓度下,酸由强到弱的顺序为:HF>H2CO3>HClO
B. 水解方程式:F-+H2O![]() HF+OH-的平衡常数为1×10-13
HF+OH-的平衡常数为1×10-13
C. 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L
D. 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(HF)>c(Na+)>c(F-)>c (H+)>c(OH-)