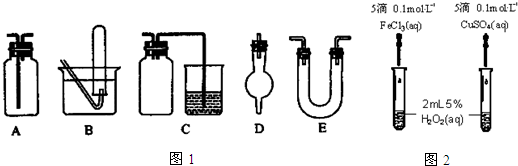
题目内容
4.阿伏加德罗常数的值为NA,则下列说法正确的是( )| A. | 1molFeI2与足量氯气反应时转移的电子数为3NA | |
| B. | 1L2mol•L-1 K2S溶液中S2-和HS-的总数为2NA | |
| C. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| D. | 50mL18mol•L-1浓硫酸与足量铜微热反应,转移的电子数为1.8NA |
分析 A.氯气足量,碘离子和亚铁离子都完全被氧化,1mol碘化亚铁完全反应失去3mol电子;
B.根据物料守恒判断,溶液中还存在硫化氢分子;
C.标准状况下,四氯化碳的状态为液体,不是气体;
D.铜与浓硫酸的反应中,浓硫酸变成稀硫酸后反应停止,则硫酸不能完全反应.
解答 解:A.1mol1molFeI2与足量氯气反应时,1mol亚铁离子失去1mol电子,2mol碘离子失去2mol电子,总共失去3mol电子,所以反应中转移的电子数为3NA,故A正确;
B.1L 2mol•L-1 K2S溶液中含有溶质硫化钾2mol,根据物料守恒可知:H2S、S2-和HS-的总数为2NA,故B错误;
C.标况下四氯化碳不是气体,不能使用标况下的气体摩尔体积计算,故C错误;
D.50mL18mol•L-1浓硫酸中含有硫酸0.9mol,铜与浓硫酸的反应中,消耗0.9mol电子会生成0.45mol电子,转移了0.9mol电子,由于浓硫酸变成稀硫酸后反应停止,则反应中转移电子小于0.9mol,转移的电子数小于0.9NA,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,B为易错点,注意物料守恒的含义应用方法.

练习册系列答案
相关题目
14.下列大小比较正确的是( )
| A. | 酸性:HClO>H2SO4>H2CO3;非金属性Cl>S>C | |
| B. | 碱性:CsOH>KOH>Mg(OH)2>NaOH; 金属性:Cs>K>Mg>Na | |
| C. | 离子半径:Na+>Mg2+>Al3+>Cl-;原子半径:Na>Mg>Al>Cl | |
| D. | 稳定性:HF>H2O>NH3>CH4; 还原性:CH4>NH3>H2O>HF |
19.下列有关反应热的叙述中正确的是( )
①已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1,则氢气的燃烧热为△H=-241.8kJ•mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)═Z(g)+W(s)△H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
④已知:
上表数据可以计算出 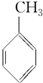 (g)+3H2(g)→
(g)+3H2(g)→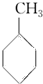 (g)的反应热;
(g)的反应热;
⑤由盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1molCO2固体时,放出的热量相等;
⑥25℃,101kPa时,1mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热.
①已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1,则氢气的燃烧热为△H=-241.8kJ•mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)═Z(g)+W(s)△H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
④已知:
| 共价键 | C-C | C═C | C-H | H-H |
| 键能/(kJ•mol-1) | 348 | 610 | 413 | 436 |
 (g)+3H2(g)→
(g)+3H2(g)→ (g)的反应热;
(g)的反应热;⑤由盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1molCO2固体时,放出的热量相等;
⑥25℃,101kPa时,1mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热.
| A. | ①②③④ | B. | ③④⑤ | C. | ④⑤ | D. | ⑥ |
14.下列实验方案正确且能达到相应实验预期目的是( )
| A. |  分离碘酒中的碘和酒精 | B. | 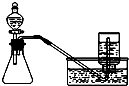 用铜和浓硝酸制取少量NO2 | ||
| C. | 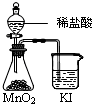 比较MnO2、Cl2、I2的氧化性 | D. | 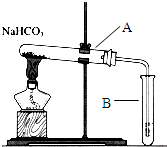 探究NaHCO3的热稳定性 |

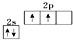 .
.