题目内容
14.下列大小比较正确的是( )| A. | 酸性:HClO>H2SO4>H2CO3;非金属性Cl>S>C | |
| B. | 碱性:CsOH>KOH>Mg(OH)2>NaOH; 金属性:Cs>K>Mg>Na | |
| C. | 离子半径:Na+>Mg2+>Al3+>Cl-;原子半径:Na>Mg>Al>Cl | |
| D. | 稳定性:HF>H2O>NH3>CH4; 还原性:CH4>NH3>H2O>HF |
分析 A、最高价氧化物对应的水化物;
B、同主族从上往下金属性增加,同周期从左到右金属性减弱,金属性越强最高价氧化物对应水化物的碱性越强;
C、电子层数越多半径越大,电子层相同,核电荷数越多半径越小;
D、非金属性越强对应氢化物越稳定,氢化物越稳定还原性越弱.
解答 解:A、最高价氧化物对应的水化物,所以酸性:HClO4>H2SO4>H2CO3>HClO,故A错误;
B、同主族从上往下金属性增加,同周期从左到右金属性减弱,金属性越强最高价氧化物对应水化物的碱性越强,所以金属性:Cs>K>Na>Mg,碱性:CsOH>KOH>NaOH>Mg(OH)2,故B错误;
C、电子层数越多半径越大,电子层相同,核电荷数越多半径越小,所以离子半径:Cl->Na+>Mg2+>Al3+,原子半径:Na>Mg>Al>Cl,故C错误;
D、非金属性越强对应氢化物越稳定,非金属性:F>O>N>C;所以稳定性:HF>H2O>NH3>CH4;氢化物越稳定还原性越弱,还原性:CH4>NH3>H2O>HF,故D正确;
故选D.
点评 本题考查学生利用元素周期律来解答,明确同主族元素性质的相似性和递变性是解答本题的关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列化学用语表达不正确的是( )
| A. | 一氯乙烷的结构式CH3CH2Cl | B. | 丙烷分子的球棍模型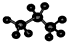 | ||
| C. | 丁烷的结构简式CH3(CH2)2CH3 | D. | 苯的分子式C6H6 |
5.在一定条件下,Ti和I2可以发生如下反应:Ti(s)+2I2(g)$→_{1300~1500℃}^{100~200℃}$ TiI4(g),下列说法正确的是( )
| A. | 该反应△S>0 | |
| B. | 利用该反应可以除去Ti中的Si | |
| C. | 在100℃时,不可能有Ti存在 | |
| D. | 增加Ti固体的量有利于平衡向右移动 |
2.下列各项化学用语中表达正确的是( )
| A. | 氯原子的结构示意图: | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | 氢氧根离子的电子式: | |
| D. | 中子数为146、质子数为92 的铀(U)原子:${\;}_{92}^{146}$U |
9.关于如图所示的原电池,下列说法正确的是( )
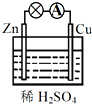

| A. | Cu为正极,SO42+向正极移动 | B. | 电子由铜片通过导线流向锌片 | ||
| C. | 该装置能将电能转化为化学能 | D. | 正极反应为 2H++2e-═H2↑ |
6.L-多巴可用于治疗帕金森综合症,其结构简式为: ,下列关于它的叙述正确的是( )
,下列关于它的叙述正确的是( )
 ,下列关于它的叙述正确的是( )
,下列关于它的叙述正确的是( )| A. | L-多巴只含有2中官能团 | |
| B. | L-多巴不能发生肽反应 | |
| C. | L-多巴既具有酸性,又具有碱性 | |
| D. | 1molL-多巴只能与含1molNaOH的溶液反应 |
3.下列图象分别表示有关反应的反应过程与能量变化的关系据此判断下列说法中正确的是( )


| A. | 石墨转变为金刚石是吸热反应 | |
| B. | CO(g)+H2O(g)═CO2(g)+H2(g)是吸热反应 | |
| C. | 相同条件下,等质量S(g)和S(s)的能量比较,S(s)较大 | |
| D. | 白磷比红磷稳定 |
4.阿伏加德罗常数的值为NA,则下列说法正确的是( )
| A. | 1molFeI2与足量氯气反应时转移的电子数为3NA | |
| B. | 1L2mol•L-1 K2S溶液中S2-和HS-的总数为2NA | |
| C. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| D. | 50mL18mol•L-1浓硫酸与足量铜微热反应,转移的电子数为1.8NA |