��Ŀ����
����Ŀ����ˮ�Ȼ�����������������Ӧ�ù㷺��
��1���Ȼ���ˮ��Һ��_____�ԣ�ԭ���ǣ������ӷ���ʽ��ʾ��________����AlCl3��Һ���ɣ����գ����õ�����Ҫ���������_______��
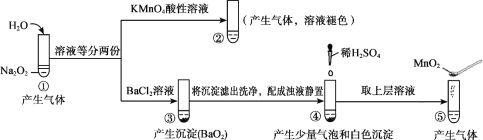
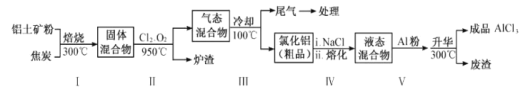
��2����ҵ������������Ҫ�ɷ�ΪAl2O3������Fe2O3��SiO2�����ʣ���ȡ��ˮ�Ȼ�����һ�ֹ�������ʾ�����£�
��֪��
���� | SiCl4 | AlCl3 | FeCl3 | FeCl2 |
�е�/�� | 57.6 | 180�������� | 300�������� | 1023 |
�ٲ�����б���ʹ����ˮ�ֻӷ���������Ŀ���࣬��������___________��ֻҪ��д��һ�֣���
�ڲ����������ͨ����������������Ӧ�������ԭ�������ȹ��ĵ�����_____��
�� ��֪��
Al2O3(s)+3C(s)=2Al(s)+3CO(g) ��H1=+1344.1kJ ��mol-1
2AlCl3(g)=2Al(s)+3Cl2(g) ��H2=+1169.2kJ ��mol-1
��Al2O3��C��Cl2��Ӧ����AlCl3���Ȼ�ѧ����ʽΪ______________��
�ܲ������ȴ�����º�������������NaOH����Һ���գ����ɵ�����Ҫ��3�֣��仯ѧʽ�ֱ�Ϊ_______�� _______ �� _________��
�ݽ�����̼�������ݷ�����������м������۵�Ŀ����___________________��
���𰸡��� Al3����3H2O![]() Al(OH)3��3H�� Al2O3 ��ֹ�����������ɵ�AlCl3ˮ�������Ӧ��ĽӴ�������ӿ췴Ӧ���� Fe���� Al2O3(s)��3C(s)��2Cl2(g)=2AlCl3(g)��3CO(g) ��H=��174.9kJ��mol��1 NaCl NaClO Na2CO3 ��ȥFeCl3�����AlCl3����
Al(OH)3��3H�� Al2O3 ��ֹ�����������ɵ�AlCl3ˮ�������Ӧ��ĽӴ�������ӿ췴Ӧ���� Fe���� Al2O3(s)��3C(s)��2Cl2(g)=2AlCl3(g)��3CO(g) ��H=��174.9kJ��mol��1 NaCl NaClO Na2CO3 ��ȥFeCl3�����AlCl3����
��������
��1��AlCl3����ǿ�������Σ�Al3+ˮ����Һ�����ԣ������������ˮ��ƽ���Ӱ�����AlCl3��Һ���ɡ����պ�õ��Ĺ��塣
��2��������ۺͽ�̿����ʹ����ˮ�ֻӷ���������Ŀ���ࡣ���������Cl2��O2��950�淴Ӧ����FeCl3��AlCl3��SiCl4��CO2��������������ʵķе㣬����������ȴ��100�棬�õ��Ĵ�Ʒ�к�AlCl3��FeCl3��β���к�Cl2��O2��CO2��SiCl4�ȣ�����V�м���Al�۳�ȥFeCl3��
(1)AlCl3Ϊǿ�������Σ�Al3����ˮ��ʹ����Һ�����ԣ�ˮ�����ӷ���ʽΪAl3����3H2O![]() Al(OH)3��3H������AlCl3��Һ���ɣ�����HCl���лӷ��ԣ�����Һ���ݳ����ٽ�Al3����ˮ�⣬����Al3+��ȫˮ������Al(OH)3���������ɡ����գ�Al(OH)3�ֽ�����Al2O3��
Al(OH)3��3H������AlCl3��Һ���ɣ�����HCl���лӷ��ԣ�����Һ���ݳ����ٽ�Al3����ˮ�⣬����Al3+��ȫˮ������Al(OH)3���������ɡ����գ�Al(OH)3�ֽ�����Al2O3��
(2) �ٲ�����б���ʹ����ˮ�ֻӷ���������û��ˮ�����Է�ֹ�����������ɵ�AlCl3ˮ�⡣������Ŀ���࣬ʹ�����ʱ�������ӿ컯ѧ��Ӧ���ʣ�
�ڲ���II�����ͨ����������������������е�Al2O3��Fe2O3��SiO2����C�����û���Ӧ���õ�Al��Fe��Si�����ԭ�������ȹ��ĵ�����Fe��
����������Ӧ���Ϊ��Ӧ�١���Ӧ�ڣ�Ӧ�ø�˹���ɣ�����Ӧ������Ӧ�ڣ����Եõ����跽��ʽAl2O3(s)+3C(s) +3Cl2(g)= 2AlCl3(g)+3CO(g)��H= +1344.1kJ ��mol-1-��+1169.2kJ ��mol-1��=��174.9kJ��mol��1�����Ȼ�ѧ����ʽΪAl2O3(s)��3C(s)��2Cl2(g)=2AlCl3(g)��3CO(g) ��H=��174.9kJ��mol��1��
��β���к�Cl2��O2��CO2��SiCl4�ȣ���ȴ�����º�������к�Cl2��O2��CO2������������NaOH����Һ���գ�������������NaOH����Һ�ķ�ӦΪ��Cl2��2NaOH=NaCl��NaClO��H2O��CO2��������NaOH����Һ�ķ�ӦΪ��CO2+2NaOH=Na2CO3+H2O������3�����ηֱ�ΪNaCl��NaClO��Na2CO3��
�ݲ������������FeCl3�����ݱ��е����ݣ����Ȼ����Ĵ�Ʒ�к���FeCl3���ʣ�����Al������FeCl3��Ӧ�û�����������AlCl3�����AlCl3�Ĵ��ȡ�

 ����ͬ�����Ծ�ϵ�д�
����ͬ�����Ծ�ϵ�д�