题目内容
【题目】某温度下,在2L密闭容器中充入4mol A气体和3mol B气体,发生下列反应:2A(g)+B(g)![]() C(g)+xD(g),5s达到平衡。达到平衡时,生成了1mol C,测定D的浓度为2mol/L。
C(g)+xD(g),5s达到平衡。达到平衡时,生成了1mol C,测定D的浓度为2mol/L。
(1)求x =____。
(2)求这段时间A的平均反应速率为_____ mol·L-1·s-1。
(3)平衡时B的浓度为______ mol·L-1。
(4)A的转化率为_________。(转化率a=![]() )
)
(5)5s达到平衡,容器内混合气体的平均相对分子质量比起始时______![]() 填“大”、“小”或“相等”,下同
填“大”、“小”或“相等”,下同![]() ,混合气体密度比起始时______。
,混合气体密度比起始时______。
【答案】4 0.2 1 50% 小 相等
【解析】
对于反应:2A(g)+B(g)![]() C(g)+xD(g),5s达到平衡。达到平衡时,生成了1mol C,测定D的浓度为2mol/L。依据题意,可建立如下三段式:
C(g)+xD(g),5s达到平衡。达到平衡时,生成了1mol C,测定D的浓度为2mol/L。依据题意,可建立如下三段式:
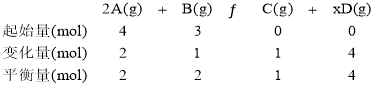
提取三段式中的数据,可回答题中的各个问题。
由分析可得出如下三段式:
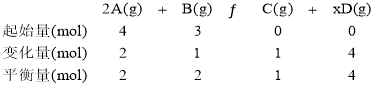
(1)利用气体的变化量之比等于化学计量数之比,很容易得出x =4。答案为:4;
(2)这段时间A的平均反应速率为![]() =0.2mol·L-1·s-1。答案为:0.2;
=0.2mol·L-1·s-1。答案为:0.2;
(3)平衡时B的浓度为![]() =1mol·L-1。答案为:1;
=1mol·L-1。答案为:1;
(4)A的转化率为![]() =50%。答案为:50%;
=50%。答案为:50%;
(5)5s达到平衡,容器内混合气体的质量不变,物质的量增大,所以平均相对分子质量比起始时小,混合气体的质量不变,气体的体积不变,所以密度与起始相等。答案为:小;相等。

 星级口算天天练系列答案
星级口算天天练系列答案【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 将 KI 溶液滴入 FeCl3 溶液中,加入 CCl4,振荡、静置,下层溶液显紫色 | 还原性:Fe2+>I |
C | 向含酚酞的 Na2CO3 溶液中加入 BaCl2 溶液,红色褪去 | Na2CO3 溶液中存在水解平衡 |
D | 某无色溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | 原溶液中一定无 NH4+ |
A. AB. BC. CD. D
【题目】以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为C(s)+H2O(g)CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。
①该反应在常温下_______(填“能”或“不能”)自发进行。
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是____(填字母,下同)。
a.容器中的压强不变
b.1 mol H—H键断裂的同时,断裂2 mol H—O键
c.c(CO)=c(H2)
d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中从反应开始至平衡以CO2表示的平均反应速率为v(CO2)=________(取小数点后两位,下同)。
②该反应的正反应为________(
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,达到平衡后下列措施中能使c(CH3OH)增大的是________。

a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1 mol CO2和3 mol H2
【题目】无水氯化铝在生产、生活中应用广泛。
(1)氯化铝水溶液呈_____性,原因是(用离子方程式表示)________;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是_______。
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:

已知:
物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 |
沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 |
①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是___________(只要求写出一种)。
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是_____。
③ 已知:
Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1344.1kJ ·mol-1
2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1169.2kJ ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为______________。
④步骤Ⅲ经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为_______、 _______ 、 _________。
⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是___________________。




