题目内容
【题目】某实验小组同学进行如下实验,以检验化学反应中的能量变化。
(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是__热反应,Ba(OH)28H2O与NH4Cl反应时,需要将固体研细其目的是_。反应过程__(填“①”或“②”)的能量变化可用图表示。

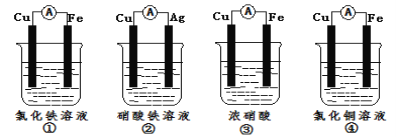
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是_(填序号)。
(3)将CH4设计成燃料电池,其利用率更高,装置如图所示(a、b为多孔碳棒)其中_(填A或B)处电极入口通甲烷,当消耗标况下甲烷33.6L时,假设能量转化率为90%,则导线中转移电子的物质的量为__mol。

(4)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:

①当电极c为Al、电极d为Cu、电解质溶液为稀硫酸时,写出该原电池正极的电极反应式为__。
②当电极c为Al、电极d为Mg、电解质溶液为氢氧化钠溶液时,该原电池的负极反应式为__。
【答案】放 扩大接触面积,提高反应速率 ① ② A 10.8 2H++2e-═H2↑ Al+4OH-﹣3e-=AlO2-+2H2O
【解析】
(1)反应①温度升高,说明是放热反应;反应②将固体研细,可以增大接触面积,提高反应速率;示意图中的反应物的总能量高于生成物的总能量,为放热反应的能量变化图,与①吻合;故答案为:放;扩大接触面积,提高反应速率;①;
(2)①的总反应为:Fe+2Fe3+=3Fe2+,Fe3+的氧化性强于Fe2+,不符合,①错误;
②的总反应为:Cu+2Fe3+=Cu2++2Fe2+,Fe3+的氧化性强于Cu2+,符合,②正确;
③的总反应为:Cu+4H++2NO3-=Cu2++2H2O+2NO2↑,NO3-的氧化性强于Cu2+,不符合,③错误;
④的总反应为:Fe+Cu2+=Cu+Fe2+,Cu2+的氧化性强于Fe2+,不符合,④错误;
答案为:②;
(3)根据示意图,a极失电子,则a极为负极,b极为正极,燃料通入燃料电池的负极,所以,A处电极入口通甲烷,负极的反应式为:CH4+10OH--8e-=CO32-+7H2O, ,n=10.8mol,故答案为:A;10.8;
,n=10.8mol,故答案为:A;10.8;
(4)①电极c为Al、电极d为Cu、电解质溶液为稀硫酸时,构成Al-Cu-H2SO4原电池,Cu作正极,H+在正极得电子生成H2,电极反应式为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
②电极c为Al、电极d为Mg,电解质溶液为氢氧化钠溶液时,构成Al-Mg-NaOH原电池,Al作负极,电极反应式为:Al+4OH-﹣3e-=AlO2-+2H2O,故答案为:Al+4OH-﹣3e-=AlO2-+2H2O。

【题目】无水氯化铝在生产、生活中应用广泛。
(1)氯化铝水溶液呈_____性,原因是(用离子方程式表示)________;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是_______。
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:

已知:
物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 |
沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 |
①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是___________(只要求写出一种)。
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是_____。
③ 已知:
Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1344.1kJ ·mol-1
2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1169.2kJ ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为______________。
④步骤Ⅲ经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为_______、 _______ 、 _________。
⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是___________________。



