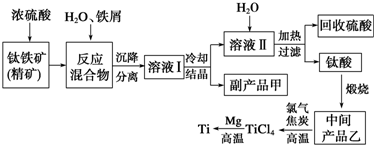
题目内容
14.两种气态烃的混合物共0.1mol,完全燃烧后生成3.58L(标准状况)二氧化碳和3.6克水,下列说法正确的是( )| A. | 一定含有乙烯 | B. | 一定含有甲烷和乙烯 | ||
| C. | 一定含有甲烷 | D. | 无法确定 |
分析 0.1mol该混合烃完全燃烧生成二氧化碳、水的物质的量分别为:n(CO2)=$\frac{3.58L}{22.4L/mol}$=0.16mol,n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,则混合的平均化学式为C1.6H4,因是混合物,则肯定含有C原子数小于1.6的烃,即一定含有甲烷,又因甲烷中含有4个氢原子,则另一种烃也含有4个氢原子,以此解答该题.
解答 解:n(CO2)=$\frac{3.58L}{22.4L/mol}$=0.16mol,n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,则混合的平均化学式为C1.6H4,由于是混合物,则肯定含有C原子数小于1.6的烃,即一定含有甲烷,因甲烷中含有4个氢原子,则另一种烃也含有4个氢原子,可能含有乙烯、丙炔,
A.根据分析可知,不一定含有乙烯,故A错误;
B.一定含有甲烷,可能含有乙烯,有可能含有丙炔,故B错误;
C.根据分析可知,混合气体中一定含有甲烷,故C正确;
D.根据分析可知,可以确定混合气体中一定含有甲烷,可能含有乙烯、丙炔,故D错误;
故选C.
点评 本题考查混合物的计算,题目难度中等,关键是利用平均分子组成判断烃的组成,常用方法有平均碳法、平均氢法、平均碳氢分子式法、平均式量法等.

练习册系列答案
相关题目
5.已知X元素的某种同位素的氯化物XCln为离子化合物,在该化合物中X元素的微粒的核内中子数为m,核外电子数为y,则该同位素的符号是( )
| A. | ${\;}_{y}^{m}$X | B. | ${\;}_{y}^{y+m}$X | C. | ${\;}_{y+n}^{m+y+n}$X | D. | ${\;}_{y+n}^{y+m-n}$X |
2.Na2O2、CaC2、CaH2、Mg3N2都能与水反应,且反应中均有气体放出.下列说法正确的是( )
| A. | 都属于氧化还原反应 | |
| B. | 等物质的量的上述物质产生气体体积(相同状况)的大小关系是:Na2O2=CaC2<CaH2=Mg3N2 | |
| C. | Na2O2、CaH2与水反应时水作氧化剂 | |
| D. | CaH2与水反应时产生H2,它既是氧化产物和又是还原产物 |
9.能正确表示下列化学反应的离子方程式是( )
| A. | 足量CO2与NaOH溶液反应:CO2+2OH-=CO32-+H2O | |
| B. | NaHCO3溶液中加入过量Ba(OH)2溶液:2HCO3-+2OH-+Ba2+=BaCO3↓+CO32-+2H2O | |
| C. | 氯化铝溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓ | |
| D. | 氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
19.下列叙述正确的是( )
| A. | 同周期主族元素的原子半径以ⅦA族的为最大 | |
| B. | 在周期表中零族元素的单质常温常压下全部是气体 | |
| C. | ⅠA、ⅡA族元素的原子,其半径越大就越容易得电子 | |
| D. | 非金属元素的最低负价都和它的族序数相等 |
3.下列化学用语的书写正确的是( )
| A. | 二氧化硅晶体的分子式:SiO2 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | F-离子结构示意图: | D. | 四氯化碳的电子式: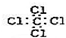 |
4.氟利昂-122的化学式是CF2Cl2,下面关于氟利昂-122的说法正确的是( )
| A. | 属于正四面体的空间结构 | B. | 分子中的碳原子是饱和的 | ||
| C. | 没有同分异构体 | D. | 是甲烷的同系物 |