题目内容
7.沼气是一种能源,它的主要成分是CH4.已知25℃时,8g CH4完全燃烧生成CO2和H2O时,放出445kJ热量,则下列热化学方程式正确的是( )| A. | 2 CH4 (g)+4O2(g)=2CO2(g)+4H2O(l)△H=+890kJ/mol | |
| B. | CH4+2 O2=CO2+2H2O△H=-890kJ/mol | |
| C. | CH4 (g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol | |
| D. | $\frac{1}{2}$CH4 (g)+O2(g)=$\frac{1}{2}$CO2(g)+H2O(g)△H=-445kJ/mol |
分析 8gCH4的n=$\frac{8g}{16g/mol}$=0.5mol,0.5mol CH4完全燃烧生成CO2和液态水时,放出445KJ热量,根据化学计量数与反应热成正比,则1molCH4在氧气中燃烧生成CO2和液态水,放出890kJ热量,应注意书写热化学方程式时标明物质的聚集状态.
解答 解:0.5mol CH4完全燃烧生成CO2和液态水时,放出445KJ热量,
1molCH4在氧气中燃烧生成CO2和液态水,放出890kJ热量,
则热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890KJ/mol,
故选C.
点评 本题主要考查了热化学方程式的书写,难度不大,根据课本知识即可完成.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.下列关于反应速率的说法正确的是( )
| A. | v=0.10 mol•L-1•s-1是指1 s内某物质的物质的量浓度为0.10 mol•L-1 | |
| B. | 对于任何化学反应来说,反应速率越快,反应现象就越明显 | |
| C. | 化学反应速率只是对可逆反应才适用 | |
| D. | 根据反应速率的大小,可以知道反应进行的相对快慢 |
2.分子间存在着分子作用间力的实验事实是( )
| A. | 食盐、氯化钾等晶体易溶于水 | |
| B. | 氯气在加压、降温时会变成液氯或固氯 | |
| C. | 融化的铁水降温可铸成铁锭 | |
| D. | 金刚石有相当大的硬度 |
12.下列分子式表示的物质一定是纯净物的是( )
| A. | CH2Cl2 | B. | C2H6O | C. | C3H6 | D. | C2H4Cl2 |
19.已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径 A>B>D>C | B. | 原子序数 d>c>b>a | ||
| C. | 离子半径 C>D>B>A | D. | 单质的还原性 A>B>D>C |
16.短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | 质子数:c>d | B. | 离子的还原性:Y2->Z- | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 原子半径:X<W |
 )的路线如下图所示:
)的路线如下图所示:
 +3NaOH$\stackrel{△}{→}$$\stackrel{△}{→}$$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$$\stackrel{△}{→}$$\stackrel{△}{→}$ +NaCl+2H2O;
+NaCl+2H2O;  ,写出其余的同分异构体的结构简式
,写出其余的同分异构体的结构简式 、
、 .
. 
 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$
 ,④的反应类型取代反应(或水解反应).
,④的反应类型取代反应(或水解反应). .
.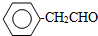 或
或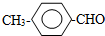 .
.